L'afnio è un elemento chimico con il simbolo Hf e il numero atomico 72. Prende il nome dal nome latino della città di Copenaghen, Hafniain cui l'elemento è stato scoperto. È un metallo di transizione grigio argento, lucido e resistente alla corrosione che si trova nel 4 ° sottogruppo (gruppo 4) o nel gruppo di titanio nella tavola periodica.
L'afnio ha proprietà molto simili allo zirconio direttamente sopra di esso nella tavola periodica. Le funzioni biologiche non sono note, normalmente non si verifica nell'organismo umano e non è tossico.
L'afnio è stato uno degli ultimi elementi stabili della tavola periodica da scoprire. La prima indicazione dell'esistenza di un altro elemento tra il lutezio e il tantalio derivò dalla legge di Moseley trovata nel 1912. Nel 1914, Henry Moseley cercò di trovare l'elemento sconosciuto, ma previsto, con il numero atomico 72 secondo questa legge in campioni di minerali delle terre rare (oggi lantanidi). Ma non ha avuto successo.
Nel suo lavoro sulla teoria atomica pubblicato nel 1922, Niels Bohr predisse che la serie di lantanidi con lutezio sarebbe terminata e che l'elemento 72 doveva quindi essere simile allo zirconio. L'afnio fu rilevato solo un anno dopo: nel 1923 a Copenaghen, Dirk Coster e George de Hevesy lo scoprirono nello zircone norvegese usando la spettroscopia a raggi X. Ulteriori indagini su altri minerali hanno dimostrato che l'afnio è sempre contenuto nei minerali contenenti zirconio. Jantzen e Hevesy riuscirono a separarli dallo zirconio cristallizzando ripetutamente i fluoruri di diammonio e dipotassio dei due elementi. L'afnio elementare potrebbe quindi essere ottenuto mediante riduzione con sodio.
Presenza
L'afnio, con un contenuto di 4,9 ppm nella crosta continentale, è un elemento poco diffuso sulla terra. In termini di frequenza, è paragonabile agli elementi bromo e cesio e più comune dell'oro e del mercurio da tempo conosciuti. L'afnio non si trova naturalmente o nei suoi minerali. I minerali di zirconio come lo zircone e la baddeleyite, invece, contengono sempre afnio; la quantità di afnio è solitamente il 2% del contenuto di zirconio (1-5 per cento in peso di afnio). Uno dei pochi minerali che contengono più afnio dello zirconio è la varietà di zirconi Alvit [(Hf, Th, Zr) SiO4].
Analogamente allo zirconio, i depositi di afnio più importanti sono i depositi di zirconio in Australia e Sud Africa. Le riserve sono stimate a 1,1 milioni di tonnellate (calcolate come ossido di afnio).
Estrazione e presentazione
Per ottenere l'afnio, deve essere separato dallo zirconio. Ciò non è possibile durante il processo di produzione, ma avviene in un processo separato. Per la separazione vengono utilizzati processi di estrazione. Viene utilizzata la diversa solubilità di alcuni sali di zirconio e afnio in solventi speciali. Esempi di ciò sono le diverse solubilità dei nitrati nel tri-n-butil fosfato e quella dei tiocianati nel metilisobutilchetone. Altre possibili opzioni di separazione sono gli scambiatori di ioni e la distillazione frazionata di composti adatti.
Dopo il processo Kroll, l'afnio separato può essere prima convertito in afnio (IV) cloruro e quindi ridotto in afnio elementare con sodio o magnesio.
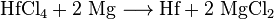
Se è necessario un afnio ancora più puro, è possibile utilizzare il processo Van Arkel de Boer. Durante il riscaldamento sotto vuoto, l'afnio reagisce inizialmente con lo iodio per formare lo ioduro di afnio (IV). Questo viene nuovamente scomposto in afnio e iodio su un filo caldo.

L'afnio viene prodotto solo in piccole quantità su una scala di 100 tonnellate. Non è prodotto internamente, ma è un sottoprodotto dell'estrazione di zirconio privo di afnio per le barre di combustibile.
Proprietà
Proprietà fisiche

Struttura cristallina di α-Hf, a = 320 pm,c = 505 pm
L'afnio è un metallo pesante argenteo lucido ad alta densità (13,31 g / cm3). Cristallizza in due diverse modificazioni a seconda della temperatura. In condizioni normali cristallizza in un impaccamento esagonale di sfere (α-Hf) ed è quindi isotipico ad α-Zr, sopra 1775 ° C si trasforma in una struttura cubica centrata sul corpo (β-Hf).
Se la purezza dell'afnio è elevata, è relativamente morbido e flessibile. È facile da lavorare rullando, forgiando e martellando. Se invece sono presenti tracce di ossigeno, azoto o carbonio nel materiale, diventa fragile e difficile da lavorare. I punti di fusione e di ebollizione dell'afnio sono i più alti nel gruppo a 2227 ° C e 4450 ° C (punto di fusione: titanio: 1667 ° C, zirconio: 1857 ° C).
In quasi tutte le altre proprietà, il metallo ricorda il suo omologo più leggero allo zirconio. Ciò è causato dalla contrazione dei lantanidi, che si traduce in raggi atomici e ionici simili (raggi atomici Zr: 159 pm, Hf: 156 pm). Un'eccezione è la densità dello zirconio con 6,5 g / cm3 ha un valore notevolmente inferiore. Una differenza tecnicamente importante è che l'afnio può assorbire i neutroni 600 volte meglio. Questo è il motivo per cui l'afnio deve essere separato per l'uso dello zirconio nelle centrali nucleari.
L'afnio è superconduttore al di sotto della temperatura di transizione di 0,08 K.
Proprietà chimiche
L'afnio è un metallo di base che reagisce con l'ossigeno per formare biossido di afnio quando riscaldato. Anche altri non metalli, come azoto, carbonio, boro e silicio, formano composti in queste condizioni. Uno strato denso di ossido si forma rapidamente a temperatura ambiente, che passiva il metallo e lo protegge da un'ulteriore ossidazione.
L'afnio è stabile nella maggior parte degli acidi grazie alla sua passivazione in condizioni normali. Si corrode rapidamente in acido fluoridrico; una notevole corrosione si verifica in acido solforico e fosforico caldo e concentrato. Le miscele di acido cloridrico-acido nitrico, inclusa l'acqua regia, devono essere esposte all'afnio solo per un breve periodo, anche a temperatura ambiente; a 35 ° C, devono essere previste velocità di rimozione superiori a 3 mm / anno. In basi acquose resiste fino ad una temperatura di circa 100 ° C, l'asportazione di materiale è solitamente inferiore a 0,1 mm / anno.
isotopo
Ci sono un totale di 35 isotopi e 18 isomeri nucleari di afnio 153Hf a 188Hf noto. L'afnio naturale è un elemento misto costituito da un totale di sei diversi isotopi. L'isotopo più comune è con una frequenza del 35,08% 180Hf. Segue 178Hf con il 27,28%, 177Hf con il 18,61%, 179Hf con il 13,62%, 176Hf con il 5,27% e 174Hf allo 0,16%. L'unico isotopo naturale è 174Hf debolmente radioattivo, è un emettitore alfa con un'emivita di 2 x 1015 Anni. Gli isotopi 177Hf e 179Hf può essere rilevato con l'aiuto della spettroscopia NMR.
L'isomero centrale 178 2mCon un'emivita di 31 anni, Hf è longevo e allo stesso tempo emette una forte radiazione gamma di 2,45 MeV quando decade. Questa è l'energia più alta emessa da un isotopo stabile per un lungo periodo di tempo. Una possibile applicazione è quella di utilizzare questo isomero centrale come sorgente in potenti laser. Nel 1999, Carl Collins ha scoperto che l'isomero può rilasciare la sua energia in un colpo solo se esposto ai raggi X. Tuttavia, le possibili applicazioni come gli esplosivi sono improbabili.
Utilizzare
Foglio di afnio da rifiuti industriali
Poiché è difficile da ottenere, l'afnio viene utilizzato solo in piccole quantità. La principale area di applicazione è la tecnologia nucleare, in cui l'afnio viene utilizzato come barra di controllo per regolare la reazione a catena nei reattori nucleari. L'uso dell'afnio presenta numerosi vantaggi rispetto ad altre possibili sostanze che assorbono i neutroni. L'elemento è molto resistente alla corrosione e la reazione nucleare con i neutroni crea isotopi di afnio, che hanno anche sezioni d'urto ad alto assorbimento. A causa del prezzo elevato, spesso è adatto solo per applicazioni militari, ad esempio per i reattori nei sottomarini atomici.
Ci sono alcuni altri usi. L'afnio reagisce rapidamente con piccole quantità di ossigeno e azoto e può quindi essere utilizzato come sostanza getter per rimuovere le quantità più piccole di queste sostanze dai sistemi di ultra alto vuoto. Quando viene bruciato, il metallo emette una luce molto brillante. È quindi possibile utilizzare l'afnio in lampade flash con un'efficienza luminosa particolarmente elevata. Diversi composti molto stabili e ad alto punto di fusione, in particolare nitruro di afnio e carburo di afnio, possono essere ottenuti dagli elementi.
Nelle leghe con metalli come niobio, tantalio, molibdeno e tungsteno, un'aggiunta del 2% di afnio aumenta la resistenza. Vengono creati materiali particolarmente stabili, ad alto punto di fusione e resistenti al calore.
sicurezza
Come molti altri metalli, l'afnio è altamente infiammabile e piroforico nel suo stato finemente suddiviso. D'altra parte, allo stato compatto non è infiammabile. Il metallo non è tossico. Per questi motivi, non è necessario osservare particolari norme di sicurezza durante la manipolazione dell'afnio.
Connessioni
L'afnio forma una serie di composti. Questi sono principalmente sali o cristalli misti e spesso hanno punti di fusione elevati. Lo stato di ossidazione più importante dell'afnio è + IV, ma sono noti composti in stati di ossidazione inferiori, da 0 a + III, e nei complessi anche stati di ossidazione negativi.
Afnio (IV) ossido
L'ossido di afnio (IV) è un solido molto stabile e ad alto punto di fusione. Ha un'elevata permettività relativa di 25 (per confronto: biossido di silicio: 3,9). Questo è il motivo per cui può essere utilizzato come dielettrico ad alta k per isolare la connessione di controllo (gate) per i microprocessori. Riducendo ulteriormente le larghezze delle strutture, le correnti di dispersione stanno diventando un problema sempre maggiore, poiché la miniaturizzazione delle strutture CMOS richiede anche un isolamento del gate più sottile. La corrente di dispersione indesiderata aumenta bruscamente al di sotto di 2 nm a causa dell'effetto tunnel. Utilizzando un dielettrico ad alta k, lo spessore del dielettrico può essere nuovamente aumentato per ridurre la corrente di dispersione senza che il transistor abbia una perdita di prestazioni (riduzione della velocità di commutazione). Pertanto, i dielettrici più spessi consentono un'ulteriore miniaturizzazione.
Altri composti dell'afnio
Il carburo di afnio è una delle sostanze con i punti di fusione più elevati. Insieme al nitruro di afnio e al boruro di afnio, è uno dei materiali duri.
Esistono alcuni composti alogeni noti dell'afnio. Nello stato di ossidazione + IV esistono sia il fluoruro che il cloruro, il bromuro e lo ioduro. L'afnio (IV) cloruro e afnio (IV) ioduro svolgono un ruolo nella produzione dell'afnio. Negli stati di ossidazione inferiore sono noti solo composti di cloro e bromo e ioduro di afnio (III).
Il potassio hexafluoridohafnate (IV) K2[HFF6] nonché l'esafluoridohafnato di ammonio (IV) (NH4)2[HFF6] può essere usato per separare l'afnio dallo zirconio, poiché entrambi i sali sono più solubili dei corrispondenti complessi di zirconio.
| Generale | |||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, simbolo, numero atomico | Afnio, Hf, 72 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | I metalli di transizione | ||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 4, 6, d | ||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | grigio acciaio | ||||||||||||||||||||||||||||||||||||||||||||||||
| numero CAS | 7440-58-6 | ||||||||||||||||||||||||||||||||||||||||||||||||
| Frazione di massa del guscio di terra | 4,2 ppm | ||||||||||||||||||||||||||||||||||||||||||||||||
| nucleare | |||||||||||||||||||||||||||||||||||||||||||||||||
| massa atomica | 178,49 u | ||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calcolato) | 155 (208) pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 150 pm | ||||||||||||||||||||||||||||||||||||||||||||||||
| configurazione elettronica | [Xe] 4f14 5d2 6s2 | ||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizzazione | 658,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizzazione | 1440 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 3. ionizzazione | 2250 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| 4. ionizzazione | 3216 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| fisicamente | |||||||||||||||||||||||||||||||||||||||||||||||||
| stato fisico | fisso | ||||||||||||||||||||||||||||||||||||||||||||||||
| modifiche | due (α- / β-Hf) | ||||||||||||||||||||||||||||||||||||||||||||||||
| struttura cristallina | esagonale | ||||||||||||||||||||||||||||||||||||||||||||||||
| densità | 13,28 g / cm3 (25 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| durezza Mohs | 5,5 | ||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | paramagnetico ( = 7,0 10-5) = 7,0 10-5) |
||||||||||||||||||||||||||||||||||||||||||||||||
| punto di fusione | 2506 K (2233 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| punto di ebollizione | 4876 K (4603 ° C) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 13,44 · 10-6 m3/ mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di vaporizzazione | 630 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| calore di fusione | 25,5 kJ / mol | ||||||||||||||||||||||||||||||||||||||||||||||||
| pressione di vapore | 0,00013 Pa a 1970 K. | ||||||||||||||||||||||||||||||||||||||||||||||||
| velocità del suono | 3010 m / s su 293,15 K | ||||||||||||||||||||||||||||||||||||||||||||||||
| Capacità termica specifica | 140 J / (kg · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 3,12 · 106 A / (V · m) | ||||||||||||||||||||||||||||||||||||||||||||||||
| conducibilità termica | 23 W / (m · K) | ||||||||||||||||||||||||||||||||||||||||||||||||
| Chimico | |||||||||||||||||||||||||||||||||||||||||||||||||
| stati di ossidazione | 4 | ||||||||||||||||||||||||||||||||||||||||||||||||
| potenziale normale | −1,505 V (HfO2 + 4 H.+ + 4 e- → Hf + 2 H2O) |
||||||||||||||||||||||||||||||||||||||||||||||||
| elettronegatività | 1,3 (scala Pauling) | ||||||||||||||||||||||||||||||||||||||||||||||||
| isotopo | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| proprietà NMR | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||
| sicurezza | |||||||||||||||||||||||||||||||||||||||||||||||||
|
|||||||||||||||||||||||||||||||||||||||||||||||||



