Scandio, Sc, numero atomico 21
generale
Lo scandio (dal latino Scandia "Scandinavia") è un elemento chimico con il simbolo Sc e il numero atomico 21.
Nella tavola periodica è nel 3° sottogruppo (gruppo 3) o gruppo dello scandio. L'elemento morbido, bianco-argento è il primo dei metalli di transizione ed è anche assegnato ai metalli delle terre rare.

Metallo scandio
Lo scandio fu scoperto da Lars Fredrik Nilson nel 1879. Da 10 kg di euxenite e gadolinite, isolò un ossido con proprietà precedentemente sconosciute. Ha chiamato il nuovo elemento che sospettava "Scandium" in onore della sua patria. Già nel 1869, Dmitri Ivanovich Mendeleev predisse un elemento Eka-Bor con il numero atomico 21. Solo Per Teodor Cleve riconobbe in seguito la corrispondenza tra scandio ed eka-boro.Lo scandio puro fu prodotto per la prima volta per via elettrolitica nel 1937 da una fusione eutettica di potassio, litio e cloruro di scandio a 700-800°C.
Lo scandio è uno degli elementi rari. Elementale non si verifica, solo in alcuni minerali rari lo si trova in forma arricchita:
Thortveitit: (Sc, Y) 2Si2O7
Euxenite: (Y, Ca, Ce, U, Th) (Nb, Ta, Ti) 2O6
Gadolinit Y2Fe2+Be2Si2O10
Ixiolite: (Ta, Nb, Sn, Mn, Fe) 4O8
Bazzit: (Sc, Al) 2Be3Si6O18
Kolbeckite: ScPO4 · 2 H2O
Tavola-periodica-scandio-21
Lo scandio si trova a basse concentrazioni in oltre i minerali 800. È quindi anche incluso nei concentrati di minerali dei metalli di transizione come "impurità". Questi includono concentrati di tungsteno e tantalite russi e cinesi. I composti di scandio sono anche prodotti nella lavorazione di minerali contenenti uranio.
Il colore blu dell'acquamarina, una varietà di berillo, è causato dagli ioni Sc3 +.
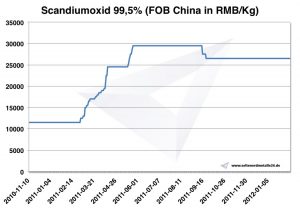
Grafico ossido di scandio 2010-2012
recupero
Il materiale di partenza è principalmente la thortveitite, che viene trasformata in diversi passaggi in ossido di scandio. Lo scandio metallico viene quindi generato dalla conversione in fluoruro e dalla riduzione con calcio.
Particolaritá
A causa della sua densità, lo scandio è uno dei metalli leggeri. Diventa opaco all'aria e si forma uno strato protettivo di ossido giallastro. Lo scandio reagisce con acidi diluiti per formare idrogeno e cationi trivalenti. A partire da 600°C, la conversione in ossido di scandio Sc2O3 avviene in vapore. Nelle soluzioni acquose, i cationi Sc si comportano in modo simile all'alluminio, il che spesso causa difficoltà nelle separazioni analitiche. In una miscela di acido nitrico e acido fluoridrico al 48%, dovrebbe essere resistente.
Utilizzare
Lo scandio viene utilizzato principalmente come ioduro di scandio nelle lampade a vapori di mercurio ad alte prestazioni e ad alta pressione, ad esempio per l'illuminazione degli stadi. Insieme all'olmio e al disprosio, viene creata una luce simile alla luce del giorno. Lo scandio è anche usato per produrre cristalli laser. L'ossido di scandio viene aggiunto ai supporti di memorizzazione dei dati magnetici per aumentare la velocità di inversione della magnetizzazione. Lo scandio come cloruro di scandio viene utilizzato in micro quantità come componente molto importante nel catalizzatore nella produzione di acido cloridrico.
Come additivo per le leghe, lo scandio mostra effetti di stabilizzazione della struttura e di affinamento della granulometria. Una lega di alluminio-litio con una bassa aggiunta di scandio viene utilizzata per fabbricare alcuni componenti degli aerei da combattimento russi. Le leghe di scandio sono utilizzate anche nella moderna industria delle biciclette (vedi bici da corsa). Queste leghe contengono anche relativamente poco scandio.
La polvere di scandio è infiammabile e quindi classificata come infiammabile.
| Generale | |
| Nome, simbolo
ordinale |
Scandio, Re, 21 |
| Serie | I metalli di transizione |
| Gruppo, periodo, blocco | 3, 4, d |
| Aspetto | bianco argenteo |
| numero CAS | 7440-20-2 |
| Frazione di massa dell'involucro della terra | 5,1 ppm |
| nucleare | |
| massa atomica | 44,955910 u |
| raggio atomico | 160 pm |
| Raggio covalente | 170 pm |
| Elektronenkonf. | [Ar] 3d (1) 4s2 |
| 1. ionizzazione | 633,1 KJ / mol |
| 2. ionizzazione | 1235,0 KJ / mol |
| 3. ionizzazione | 2388,6 KJ / mol |
| fisicamente | |
| stato fisico | fisso |
| struttura cristallina | esagonale |
| densità | 2,985 g / cm3 |
| magnetismo | paramagnetico (χm = 2,6 * 10 (-4)) |
| punto di fusione | 1814 K (1541 C) |
| punto di ebollizione | 3103 K (2830 C) |
| Volume molare | 15,00 * 10 (-6) m (3) / mol |
| Calore di vaporizzazione | 318 KJ / mol |
| calore di fusione | 16,0 KJ / mol |
| Conducibilità elettrica | 1,81 * 10 (6) A / (V * m) |
| conducibilità termica | 16 W / (m * K) |
