Magnesio, Mg, numero atomico 12
Prezzo, storia, occorrenza, estrazione e uso del magnesio
Il magnesio è un elemento chimico con l'elemento simbolo Mg (Alchemy: ⚩) e il numero atomico 12. Nella tavola periodica degli elementi è nel secondo gruppo principale o 2. Gruppo IUPAC e quindi appartiene ai metalli alcalini della terra.
Il magnesio è uno dei dieci elementi più comuni della crosta terrestre. Si presenta in numerosi minerali e nel verde delle foglie delle piante.
Storia
L'origine della designazione dell'elemento è mostrata diversamente nella letteratura:
- del greco antico μαγνησία λίθος che significa "pietra magnetica",
- Magnisia, un'area nella Grecia orientale,
- dalla Magnesia, una città dell'Asia Minore nel territorio della Turchia di oggi.
Tuttavia, tutte le derivazioni qui fornite sembrano etimologicamente derivare dai magneti o dai loro omonimi Heros Magnes.
I composti di magnesio erano noti e usati per secoli prima della produzione di magnesio elementare. La magnesia alba ha designato carbonato di magnesio, mentre la magnesia era il nome comune per l'ossido di magnesio.
Il fisico e chimico scozzese Joseph Black fu il primo dei composti di magnesio nell'18. Secolo esaminato sistematicamente. 1755 nella sua opera De humore acido cibis orto et magnesia alba ha riconosciuto la differenza tra calce (carbonato di calcio) e magnesia alba (carbonato di magnesio), che all'epoca erano spesso confuse. Prese Magnesia alba come carbonato di un nuovo elemento. Per questo motivo, il Nero è spesso chiamato lo scopritore del magnesio, sebbene non abbia mai rappresentato il magnesio elementare.
1808 ha vinto Sir Humphry Davy Magnesio idruro di magnesio inumidito dall'elettrolisi con l'aiuto di una colonna di cenere Volta - non in forma pura, ma come un amalgama, poiché ha lavorato con un catodo di mercurio. Quindi ha dimostrato che la Magnesia è l'ossido di un nuovo metallo, che per primo ha chiamato Magnium.
Riscaldando il cloruro di magnesio secco con potassio come agente riducente, 1828 è riuscito a produrre piccole quantità di magnesio puro per il chimico francese Antoine Bussy. 1833 è stato il primo a produrre magnesio per elettrolisi del cloruro di magnesio fuso. Sulla base di questi esperimenti, il chimico tedesco Robert Wilhelm Bunsen ha lavorato negli anni 1840 e 1850 su processi per la produzione di magnesio mediante elettrolisi di sali fusi utilizzando l'elemento di Bunsen che ha sviluppato. 1852 ha sviluppato una cella di elettrolisi per produrre grandi quantità di magnesio dal cloruro di magnesio anidro fuso. Questo processo è ancora preferito oggi per il recupero del magnesio.
La produzione tecnica di magnesio iniziò 1857 in Francia dopo una procedura di Henri Etienne Sainte-Claire Deville e H. Caron. Nel cosiddetto processo Deville-Caron, una miscela di cloruro di magnesio anidro e fluoruro di calcio viene ridotta con sodio. In Inghilterra, Johnson Matthey ha iniziato a produrre 1860 usando un processo simile. Tuttavia, a causa di difficoltà produttive, queste prime iniziative sono rimaste antieconomiche.
Presenza
Il magnesio non esiste in natura a causa della sua reattività in forma elementare. Come minerale, si presenta principalmente sotto forma di carbonati, silicati, cloruri e solfati. Sotto forma di dolomite, un minerale di magnesio si forma persino in montagna, ad esempio. B. nelle Dolomiti.
I minerali più importanti sono dolomite CaMg (CO3) 2, magnesite (bitterspar) MgCO3, olivina (Mg, Fe) 2 [SiO4], enstatite MgSiO3 e kieserite MgSO4 · H2O.
Altri minerali sono:
- Serpentine Mg3 [Si2O5] (OH) 4
- Talco Mg3 [Si4O10] (OH) 2
- Sepiolite Mg4 [Si6O15] (OH) 2
- Schönit K2Mg (NUMERO DI SOX) 4 · 2 H6O
- Carnallite KMgCl3 · 6 H2O
- Spinello MgAl2O4
Se disciolto in acqua, provoca durezza dell'acqua insieme al calcio. Nell'acqua di mare è contenuto più di 1 kg / m³.
Estrazione e presentazione
L'estrazione del magnesio avviene principalmente in due modi:
- Elettrolisi a flusso di fusione del cloruro di magnesio fuso nelle cellule dei bassi: le cellule dei bassi sono costituite da grandi trogoli di ferro riscaldati dal basso. Come anodi servono da sopra barre di grafite incorporate, che sono circondate alle punte di un catodo anulare. Il magnesio metallico si accumula sul sale fuso e viene scremato. Il gas di cloro risultante si raccoglie nella parte superiore della cellula e viene riutilizzato per produrre cloruro di magnesio dall'ossido di magnesio. Per abbassare il punto di fusione del cloruro di magnesio, cloruro di calcio e cloruro di sodio vengono aggiunti al sale fuso.
- Riduzione termica dell'ossido di magnesio (processo di Pidgeon): in un contenitore di acciaio al cromo-nichel viene riempita la dolomite, la barite e un agente riducente come il ferrosilicio. Viene quindi evacuato (pompato dal gas) e riscaldato a 1160 ° C. Il magnesio vaporoso si condensa sul tubo di raffreddamento raffreddato ad acqua all'esterno della fornace. Il magnesio recuperato viene ulteriormente purificato mediante distillazione sotto vuoto.
Il processo Pidgeon è oggi il processo di produzione più significativo ed è utilizzato principalmente in Cina.
88% della produzione mondiale di magnesio ha luogo in Cina, dove 2015 ha prodotto circa 800.000 t di magnesio metallico. A questo segue solo una percentuale di quote di mercato per Russia, Israele e Kazakistan.
La produzione di 1 kg di magnesio mediante il processo Pidgeon produce gas a effetto serra con un CO2 equivalente di circa 31 kg (per confronto: per 1 kg di acciaio, gli equivalenti CO0,5 sono formati tra 2 e 2 kg).
Sebbene il magnesio sia contenuto in più dei minerali 60, solo la dolomite, la magnesite, la brucite, la carnallite, il talco e l'olivina sono di importanza commerciale.
Il catione Mg2 + è il secondo catione più abbondante nell'acqua di mare, rendendo le acque commerciali e il sale marino attraenti fonti commerciali di magnesio. Per estrarlo, l'idrossido di calcio viene aggiunto all'acqua di mare per formare un precipitato di idrossido di magnesio.
L'idrossido di magnesio (brucite) è insolubile in acqua e può essere filtrato e fatto reagire con acido cloridrico per dare cloruro di magnesio concentrato.
L'elettrolisi produce cloruro di magnesio dal cloruro di magnesio.
Proprietà
La lega di magnesio solido, argenteo lucido è circa un terzo più leggera dell'alluminio. Il magnesio puro ha una bassa resistenza e durezza. Il suo modulo riguarda 45 GPa. Nell'aria, il magnesio è rivestito con uno strato di ossido che, a differenza dell'alluminio, non è completamente opaco. La ragione di ciò è che l'ossido di magnesio ha un volume molare inferiore rispetto al magnesio stesso (MgO: 10,96 cm3 / mol, Mg: 13,96 cm3 / mol); s. rapporto pilling-Bedworth.
Strisce sottili o fogli si accendono facilmente. Brucia in aria con una fiamma bianca brillante a ossido di magnesio MgO e poco nitruro di magnesio Mg3N2. La polvere di magnesio appena prodotta può riscaldarsi nell'aria fino a quando non si accende spontaneamente. Si prevedono reazioni pericolose a temperature più elevate, in particolare con il liquido fuso. Anche in molti ossidi come il monossido di carbonio, l'ossido di azoto e l'anidride solforosa brucia magnesio.
Il magnesio reagisce con l'acqua per formare idrogeno:
Reazione di magnesio con acqua
Ciò forma un rivestimento scarsamente solubile di idrossido di magnesio, che arresta in gran parte la reazione (passivazione). Anche gli acidi deboli, come i sali di ammonio, sono sufficienti per dissolvere lo strato di idrossido, poiché convertono gli ioni idrossido in acqua e formano sali solubili. Senza passivazione, la reazione esotermica procede violentemente; più fine è la polvere di magnesio, più violenta. Con l'aria, l'idrogeno rilasciato forma facilmente una miscela esplosiva (ossigeno ossidrogeno).
Il magnesio reagisce esotermicamente con l'anidride carbonica per formare ossido di magnesio e carbonio:
Reazione di magnesio con anidride carbonica
Pertanto, l'anidride carbonica non estingue gli incendi di magnesio, ma li alimenta.
È relativamente resistente all'acido fluoridrico e alle basi, a differenza dell'alluminio. La ragione di ciò è la bassa solubilità del fluoruro di magnesio (MgF2), che impedisce l'ulteriore formazione di ioni Mg (OH) 3.
isotopo
Sono noti un totale di isotopi 21 tra 19Mg e 40Mg di magnesio. Di questi, tre, gli isotopi 24Mg, 25Mg e 26Mg sono stabili e si presentano in natura. L'isotopo con la proporzione maggiore della composizione isotopica naturale è 24Mg con 78,99%, 25Mg ha una quota di 10,0% e 26Mg di 11,01%. Gli isotopi instabili di più lunga durata sono 28Mg, che si trasforma in 20,915Al con un'emivita di 28 ore in decadimento beta e 27Mg, che decade anche in 9,435Al con un'emivita di 27 minuti in decadimento beta. Tutti gli altri isotopi hanno solo emivite brevi di secondi o millisecondi.
Utilizzare
Magnesio metallico
La polvere e il filo di magnesio sono utilizzati in dispositivi incendiari, bombe e munizioni leggere, precedentemente anche come polvere flash. Spesso le barre di magnesio agiscono come anodi sacrificali, proteggendo parti di metalli più nobili dalla corrosione.
Nella metallurgia, il magnesio trova un uso versatile,
- come agente riducente nel processo di Kroll per il recupero del titanio,
- come agente riducente per il recupero di uranio, rame, nichel, cromo e zirconio,
- come componente delle leghe di alluminio dei gruppi AlSiMg e AlMg,
- come granuli di magnesio per la desolforazione di ferro e acciaio,
- come aggregato per ghisa nodulare,
- come base di un gruppo di leghe leggere standardizzate per la costruzione di aeromobili e veicoli a motore (queste fusioni richiedono uno strato di copertura di cloruro di magnesio fuso per la protezione contro l'ingresso di aria e l'ossidazione, vedi trattamento di fusione),
- come combustibile per torce che bruciano sott'acqua.
In chimica organica, viene utilizzato per produrre composti Grignard.
Poiché il magnesio si accende molto facilmente, è anche usato come un accendino molto robusto. Questi blocchi di magnesio, commercializzati come Fire Starter Kits, hanno su un lato un'asta la cui abrasione si accende spontaneamente nell'aria, come la pietra focaia di un accendino. La procedura è molto simile al metodo dell'Età della Pietra per bruciare selce e esca, con il magnesio che svolge il ruolo di esca. Innanzitutto, i frammenti vengono raschiati dal blocco di magnesio con un coltello e posizionati sopra o sotto il carburante effettivo. Quindi, raschiando sul dorso "selce" (ad es. Con il dorso del coltello) si generano scintille il più vicino possibile ai trucioli di magnesio per accenderli.
leghe di magnesio
La caratteristica più importante delle leghe di magnesio, che le ha rese più importanti dell'alluminio e delle sue leghe, è la costruzione leggera che consentono. Con una densità di circa 1,75 g / cm³, la differenza rispetto alla costruzione leggera in alluminio con una densità di 2,75 g / cm³ è evidente. Inoltre, l'intervallo di fusione tra 430 e 630 ° C, vale a dire un risparmio energetico inferiore. Tuttavia, le proprietà meccaniche come la resistenza alla trazione e la durezza sono significativamente inferiori rispetto alle leghe di alluminio. La bassa densità ha reso il magnesio interessante sin dall'inizio per le applicazioni mobili. La prima grande applicazione ebbe luogo prima della prima guerra mondiale nella costruzione delle impalcature per i rigidi dirigibili Zeppelin. Nelle automobili, le leghe di magnesio sono state utilizzate per produrre parti del corpo e cerchioni per tutti i tipi di applicazioni mobili.1930 ha sempre più utilizzato leghe di magnesio nella costruzione di aeromobili a causa del suo risparmio di peso, voli più efficienti dal punto di vista energetico e carichi utili più elevati. Tutto ciò ha portato a una rapida espansione della produzione di magnesio in Germania (Elektron della fabbrica chimica Griesheim) e dopo 1940 anche negli Stati Uniti. "Elektron" è diventato un nome registrato per le prime leghe di magnesio immediatamente dopo l'inizio della produzione.
Altri usi per la fusione del magnesio si sono offerti nel corso dello sviluppo tecnico, in parte legato alla guerra, in parte costruttivo e lungimirante e allo stesso tempo ottimizzando le leghe. Come materiali a base di magnesio, sono state sviluppate le leghe Mg-Al, Mg-Mn, Mg-Si, Mg-Zn e infine Mg-Al-Zn.
La scatola del cambio del Maggiolino VW è stata fusa in milioni di strati di una lega Mg-Si. Oggi le leghe di magnesio non sono utilizzate solo dal punto di vista del risparmio di peso, ma sono anche caratterizzate da un'alta attenuazione. Ciò comporta una riduzione delle vibrazioni e dell'emissione di rumore quando sottoposti a vibrazioni. Anche per questo motivo, le leghe di magnesio sono diventate materiali interessanti nella costruzione di motori, come nell'industria automobilistica. Quindi non solo parti del motore sono realizzate in lega di magnesio, ma sempre più anche per la fusione di blocchi motore, il metodo ibrido / fusione ibrida applicato, per la prima volta nella produzione di massa in Alfa Romeo 156, successivamente anche in BMW (vedi anche BMW N52).
Nella pressofusione (vedi anche sotto lo stampaggio) possono esserci molti componenti, anche su larga scala, a pareti sottili vicino alle dimensioni finali e produrre senza costose rilavorazioni, ad esempio. Come cerchioni, profili, alloggiamenti, porte, cappe, baule, leva del freno a mano e altro. Non solo nell'industria automobilistica, ma anche nell'ingegneria meccanica è costruita con parti di leghe Mg-Al-Zn.
Gli sforzi per la costruzione leggera hanno già portato alla fine di 20. Alle leghe di magnesio e litio, anche leghe più leggere di magnesio con l'aggiunta di litio.
Materiali di magnesio in medicina
Ricerche recenti promettono un elevato potenziale di sviluppo dei materiali di magnesio come materiale di impianto riassorbibile (ad es. Come uno stent) per il corpo umano. I materiali di magnesio devono essere protetti dalla corrosione da contatto nell'applicazione. La resistenza alla corrosione contro le normali influenze atmosferiche, tuttavia, è buona. Il comportamento alla corrosione da contatto sarebbe un vantaggio decisivo se usato come materiale per impianti limitato temporaneo, poiché si dissolverebbe in modo sicuro dopo un certo tempo. Ciò ha eliminato i rischi e i costi di un intervento chirurgico di rimozione dell'impianto.
fertilizzante
Nel calcare delle aree coltivate a prato e prati, il magnesio sotto forma di ossido di magnesio o carbonato di magnesio viene usato per compensare l'esaurimento del magnesio del suolo da parte delle piante. Inoltre, aumenta il pH del suolo e migliora la disponibilità di altri nutrienti. Qui, il composto di magnesio viene solitamente applicato insieme alla calce come fertilizzante complesso contenente magnesio e calcio. Come fertilizzanti complessi si utilizzano naturalmente il fosfato di magnesio Bobierrit Mg3 (PO4) 2 (trimagnesio fosfato) e nitrato di magnesio.
Fisiologia
Il magnesio è una delle sostanze essenziali ed è quindi indispensabile per tutti gli organismi. Nel verde fogliare delle piante, la clorofilla, il magnesio è contenuto a circa il 2%. Lì forma l'atomo centrale della clorofilla. In carenza di magnesio le piante vanno in letargo e in mancanza di luce. Inoltre, il magnesio del corpo umano deve essere fornito giornalmente in quantità sufficienti per prevenire la carenza di magnesio.
Il corpo di un adulto contiene circa 20 g di magnesio (per confronto: 1000 g di calcio). Nel plasma sanguigno, il magnesio è legato allo 40% delle proteine; il livello sierico normale è 0,8-1,1 mmol / l. Il magnesio è coinvolto in alcune reazioni enzimatiche 300 come componente enzimatico o coenzima. Inoltre, gli ioni Mg liberi influenzano il potenziale delle membrane cellulari e agiscono come secondi messaggeri nel sistema immunitario. Stabilizzano il potenziale di riposo delle cellule nervose e muscolari eccitabili e delle cellule del sistema nervoso autonomo. La carenza di magnesio provoca irrequietezza, nervosismo, irritabilità, mancanza di concentrazione, stanchezza, sensazione generale di debolezza, mal di testa, aritmia cardiaca e spasmi muscolari. Può anche venire a un attacco di cuore. Nell'area del metabolismo e della psiche, si ritiene che la carenza di magnesio aggrava la depressione e la psicosi schizofrenica. Un eccesso di magnesio nel sangue può verificarsi a seguito di un'eccessiva assunzione e disfunzione renale e porta a disturbi nel sistema nervoso e nel cuore.
Il riassorbimento del magnesio si verifica prima nell'intestino tenue superiore, ma anche nel resto del tratto digestivo. Viene escreto dai reni ed è presente in quantità variabili in tutti gli alimenti e nell'acqua potabile. La dose giornaliera richiesta di circa 300 mg viene solitamente raggiunta attraverso una dieta ben bilanciata. Una maggiore necessità può essere coperta da integratori o medicinali. Una leggera carenza di magnesio è possibile a causa di gravi malattie, gravidanza o sport agonistici. Gravi carenze si verificano nella disfunzione renale, diarrea prolungata, infiammazione intestinale cronica, diabete mellito scarsamente controllato, corticosteroidi, alcuni diuretici o alcolismo con malnutrizione.
Sali di magnesio come citrato, gluconato, aspartato e aspartato cloridrato sono approvati come farmaci in Germania, in dosi giornaliere da 100 a 400 mg contro stati di carenza e disturbi neuromuscolari come spasmi muscolari, emicrania o complicanze della gravidanza. Gli effetti collaterali includono disagio gastrointestinale e diarrea, con sovradosaggio anche affaticamento e rallentamento del polso. Le controindicazioni includono disfunzione renale e alcune aritmie cardiache.
Per l'assunzione orale di integratori di magnesio (compresse, masticabili o losanghe, granuli per dissoluzione in liquido) da un lato il dosaggio è importante. Diversi studi hanno concluso che quando si assume 120 mg viene assorbito circa l'35%, ma quando si assume una dose giornaliera completa di 360 mg viene assorbito solo circa l'18%. Per l'assorbimento nel corpo, la forma dei composti usati oggi nelle medicine è irrilevante, poiché sono farmacologicamente, biologicamente e clinicamente equivalenti; I sali organici come il magnesio aspartato o il magnesio citrato vengono assorbiti dall'organismo solo più velocemente dei composti inorganici. D'altra parte, il magnesio aggiuntivo rimane benefico nel corpo solo se sono disponibili abbastanza molecole leganti nel corpo; Ciò avviene mediante aggiustamenti biochimici solo dopo un prolungato aumento dell'apporto o dell'assunzione di magnesio per almeno quattro settimane. Il solfato di magnesio ("sale di Epsom") era precedentemente usato come lassativo. I sali di magnesio sono usati nella medicina alternativa.
Alimentari
Il magnesio funge da cofattore per varie proteine 300, in particolare gli enzimi leganti ATP e acido nucleico. L'assunzione giornaliera raccomandata di magnesio nell'uomo, a seconda dell'età e del sesso, è compresa tra 24 e 400 mg al giorno.
Il magnesio viene utilizzato come composto in molti alimenti, in particolare nei prodotti integrali (ad esempio pane integrale, pasta integrale, riso integrale, farina d'avena, fiocchi di mais), acqua minerale, in particolare acqua medicinale, acqua di rubinetto con sufficiente durezza dell'acqua, fegato, pollame, pesce, semi di zucca, semi di girasole, cioccolato Anacardi, arachidi, patate, spinaci, cavolo rapa, frutti di bosco, arance, banane, sesamo, sciroppo di barbabietola da zucchero, latte e derivati.
Pericoli e misure di protezione
I pericoli del magnesio elementare dipendono fortemente dalla temperatura e dalla dimensione delle particelle: il magnesio compatto è sicuro a temperature inferiori al punto di fusione, mentre i trucioli e le polveri di magnesio sono altamente infiammabili. A causa dell'ampia superficie, quest'ultima può facilmente reagire con l'ossigeno presente nell'aria. Con polvere di magnesio molto fine c'è il pericolo di combustione spontanea; Le miscele aria-polvere sono persino esplosive. La flemmatizzazione è un trattamento che riduce i rischi nella lavorazione del magnesio, come le polveri metalliche in generale. Il magnesio fuso si accende anche spontaneamente nell'aria. Anche con molte altre sostanze, come acqua e altri composti contenenti ossigeno, reagisce il magnesio a grana fine o riscaldato. Il magnesio si scioglie quindi richiede una protezione permanente contro l'ingresso di ossigeno atmosferico. In pratica, questo viene fatto coprendo il fuso mediante agenti ricchi di cloruro di magnesio. L'esafluoruro di zolfo è adatto anche come protezione dall'ossidazione. La copertura precedentemente solita con zolfo elementare non è più praticata a causa del forte fastidio causato dal biossido di zolfo.
Negli incendi al magnesio si verificano temperature fino a circa 3000 ° C. In nessun caso si possono usare agenti estinguenti comuni come acqua, anidride carbonica, schiuma o azoto poiché il magnesio reagisce violentemente con questi. Quando l'acqua entra in un incendio di magnesio, esiste il pericolo acuto di una reazione di ossidrogeno.
Per il fuoco (fuochi metallici) di una fusione, si applica il principio estinguente del soffocamento, vale a dire il rapido spostamento dell'ossigeno. Nel caso più semplice coprendo con sabbia asciutta, altrimenti applicando un sale coprente per sciogliere il magnesio. Polvere estinguente di classe di fuoco D, polvere di magnesia (magnesia usta / magnesia bruciata), se necessario, sono adatti anche i trucioli di ricino grigi asciutti.
Quando si utilizza il magnesio, pertanto, tutte le istruzioni di sicurezza fornite devono essere seguite esattamente. In nessun caso dovrebbe essere creata un'atmosfera esplosiva (polvere di magnesio, idrogeno, aerosol e vapori di lubrificanti per raffreddamento combustibili). Devono inoltre essere osservate le normali misure di sicurezza sul lavoro, come la prevenzione delle fonti di ignizione.
prova
Il modo migliore per rilevare il magnesio è con Magneson II, Titangelb o Chinalizarin.
Per il rilevamento con Magneson II (4- (4-nitrofenilazo) -1-naftolo), la sostanza madre viene sciolta in acqua e resa alcalina. Successivamente, vengono aggiunte alcune gocce di una soluzione del colorante azoico Magneson II. In presenza di ioni magnesio, si forma un lago di colore blu scuro. Altri metalli alcalini terrosi dovrebbero essere precedentemente rimossi mediante precipitazione sotto forma di carbonati.
Per la rilevazione con Titangelb (Thiazolgelb G), la sostanza madre viene sciolta in acqua e acidificata. Viene quindi miscelato con una goccia di soluzione di Titangelb e reso alcalino con soluzione di idrossido di sodio diluita. La presenza di magnesio produce un precipitato rosso brillante. Gli ioni di nichel, zinco, manganese e cobalto interferiscono con questo rilevamento e devono prima essere precipitati come solfuri.
Per il rilevamento con quinalizarina, la soluzione campione di acido viene miscelata con due gocce della soluzione colorante. Quindi diluire la soluzione di idrossido di sodio fino alla reazione di base. Una macchia blu o precipitato indica magnesio.
Come reazione di rilevazione per sali di magnesio e la formazione di precipitati possono essere utilizzati con soluzioni saline di fosfato. La soluzione campione pesante senza ammoniaca, con ammoniaca e cloruro di ammonio a pH da 8 a 9 viene aggiunta ad essa con una soluzione di sodio fosfato di idrogeno. Una torbidità bianca solubile in acido dovuta al magnesio fosfato di ammonio MgNH4PO4 indica ioni magnesio:
Dalla soluzione ammoniacale Mg2 + può anche essere rilevato con l'ossina come composto giallo-verdastro con parsimonia solubile. Questa prova è adatta per il processo di separazione cationica.
Connessioni
Nei composti, il magnesio si presenta quasi esclusivamente come catione bivalente con lo stato di ossidazione 2.
Ossidi e idrossidi
L'ossido di magnesio (magnesia) forma cristalli incolori nella struttura del cloruro di sodio. In natura, si presenta come un periclas minerale vulcanico. Sono di colore da bianco a grigio, inclusioni anche verde scuro, cristalli regolari vetrosi lucidi. Viene aggiunto agli alimenti come regolatore di acidità o agente di rilascio e ha anche varie applicazioni ingegneristiche nei laboratori e nell'industria. In medicina è usato per la terapia sostitutiva.
L'idrossido di magnesio è un sale incolore e fortemente basico che si presenta naturalmente come una brucite minerale. Ha una struttura a cristalli trigonali nel gruppo spaziale P3m1 (gruppo ambiente n. 164) ed è usato come additivo per olio commestibile (per la fissazione del biossido di zolfo), come flocculante per il trattamento delle acque reflue, come ritardante di fiamma in termoplastici (poliolefine, cloruro di polivinile) ed elastomeri e come additivo nei detergenti utilizzato. In medicina, è usato come antiacido per la neutralizzazione dell'acido gastrico e come lassativo lieve usato.
Il perossido di magnesio è un composto finemente incolore e incolore che ha una struttura a cristalli di pirite nel gruppo spaziale Pa3 (gruppo spaziale numero 205). Assomiglia al perossido di calcio e rilascia ossigeno per reazione controllata con soluzioni acquose. Ha varie applicazioni in agricoltura, farmacia e cosmetici.
alogenuri
Il cloruro di magnesio è altamente igroscopico e si trova in natura nella bishopite minerale (MgCl2 · 6 H2O), come carnallite a doppio sale (KMgCl3 · 6 H2O), in acqua di mare e nei laghi salati. Si cristallizza nel sistema dei cristalli trigonali nel gruppo spaziale R3m (numero del gruppo spaziale 166). Nella tecnologia alimentare, viene utilizzato come regolatore di acidità, consolidante, esaltatore di sapidità, vettore o agente di rilascio. Il cloruro di magnesio esaidrato, come batteria termica, può immagazzinare e rilasciare energia termica.
Il fluoruro di magnesio forma cristalli incolori che si cristallizzano tetragonalmente nella struttura del rutilo nel gruppo spaziale P42 / mnm (spazio gruppo numero 136). Le sue proprietà ottiche e la sua stabilità chimica lo rendono un materiale importante per applicazioni ottiche.
Il bromuro di magnesio e lo ioduro di magnesio sono anche sali igroscopici che hanno una struttura cristallina trigonale nel gruppo spaziale P3m1 (numero del gruppo spaziale 164).
Altri composti inorganici
Il carbonato di magnesio si presenta in natura in grandi quantità come magnesite (bitterspar). Cristallizza il trigonale nel gruppo spaziale R3c (numero del gruppo spaziale 167). Nell'industria alimentare, viene aggiunto come regolatore di acidità, vettore o agente di rilascio. È usato per arrampicata e ginnastica ed è anche conosciuto come Magnesia e Chalk. Gli atleti si asciugano quindi nei palmi prima di iniziare a praticare in modo che la loro pelle non si attacchi troppo quando afferrano le barre delle barre o le barre di ferro della barra orizzontale o del bilanciere. Ha anche applicazioni mediche e industriali.
Il nitrato di magnesio è un sale igroscopico incolore che è facilmente solubile in acqua. L'esaidrato (Mg (NO3) 2.6 H2O) ha una struttura cristallina monoclina con il gruppo spaziale P21 / c (numero del gruppo spaziale 14). È usato come fertilizzante, accumulo di calore latente (come esaidrato) o nell'industria della ceramica.
Solfato di magnesio eptaidrato (Mg (SO4) · 7 H2O) è noto come Mineral Epsomit. Forma cristalli incolori che formano un reticolo cristallino pseudotetragonale rombico. I cristalli spesso fioriscono in aggregati fibrosi e formano stalattiti. È usato per fertilizzanti, come agente essiccante e per applicazioni mediche.
I fosfati di magnesio (diidrogeno fosfato di magnesio (Mg (H2PO4) 2), il fosfato di magnesio idrogeno (MgHPO4) e il fosfato di magnesio (Mg3 (PO4) 2) sono utilizzati nell'industria come materia prima ceramica e come ritardanti di fiamma. Nell'industria alimentare, sono utilizzati come additivo per mangimi, lassativo e additivo alimentare. Gli alimenti vengono aggiunti come un regolatore di acidità o agente di rilascio.
Lo spinello è un minerale frequente nella classe minerale di ossidi e idrossidi con composizione chimica idealizzata MgAl2O4 ed è quindi chimicamente un alluminato di magnesio. Si cristallizza isotipicamente con la magnetite nel sistema di cristalli cubici nel gruppo spaziale Fd3m (numero del gruppo spaziale 227).
La dolomite è un minerale molto comune della classe minerale di carbonati e nitrati con la composizione chimica CaMg [CO3] 2 ed è quindi chimicamente un carbonato di calcio-magnesio. Si cristallizza nel sistema di cristalli trigonali nel gruppo spaziale R3 (numero del gruppo spaziale 148).
L'idruro di magnesio può essere usato come accumulo di idrogeno e energia. L'idrogeno rilasciato dall'idruro di magnesio può produrre una schiuma metallica con proprietà interessanti che è più leggera dell'acqua.
Altri composti di magnesio cristallino interessanti includono, ad esempio, diboruro di magnesio, carburo di magnesio, nitruro di magnesio, solfuro di magnesio, silicuro di magnesio, germanuro di magnesio, metasilicato di magnesio, ossido di titanio di magnesio e polonide di magnesio.
magnesio-organico
Gli organyl di magnesio sono composti organometallici in cui esiste un legame tra magnesio e carbonio. Tra i composti organici di Grignard (R-Mg-X) sono di gran lunga i più importanti. Organi binari di magnesio e alogenuri di alchenilmagnesio svolgono un ruolo significativamente subordinato.
Organylmagnesiumhalogenide
Gli alogenuri di organilmagnesio (di solito chiamati composti di Grignard) sono ottenuti in un processo diretto dalla reazione degli alogenuri di organo con torniture di magnesio. I composti Grignard sono in soluzione nell'equilibrio di Schlenk. Reagiscono con la sostituzione dell'alogeno-organile con gli organi elementali:
Generale:
z. Per esempio:
o mediante aggiunta di organi con sistemi a più legami:
Generale:
z. B.:
Gli organelli binari di magnesio (R2Mg, detti anche diorganili di magnesio) possono essere prodotti in vari modi:
per transmetalazione, ad esempio diorganilene al mercurio:
per mutazione nello spostamento dell'equilibrio di Schlenk con l'aiuto del diossano 1,4:
I magnesacicli (alcani ciclici con magnesio nell'anello) possono anche essere preparati con il diossano 1,4.
mediante metatesi dei composti di Grignard con organyl di litio
mediante idromagnesizzazione (aggiunta di MgH2 agli alcheni 1):
mediante l'aggiunta di magnesio elementare a doppi legami C = C in alcuni idrocarburi insaturi come 1,3-butadiene o antracene (aggiunta di metallo). Ad esempio, è possibile la reazione di 1,3-butadiene nel tetraidrofurano a temperatura ambiente:

Il butadiene di magnesio prodotto, chiamato anche magnesio (2-butene-1,4-diile), può servire come fonte di anioni di butadiene in ulteriori sintesi. Allo stesso modo, viene mostrato l'antracene di magnesio giallo arancio. Il magnesio antracene può quindi essere usato come catalizzatore per l'idrogenazione del magnesio.
alkenylmagnesium
Gli alchini reagiscono con gli alcheni per fornire alogenuri di alchenilmagnesio nel corso della cosiddetta carbomagnesazione:

Altri composti organici
L'idrogeno citrato di magnesio e il dicagnato di trimagnesio sono sali di magnesio dell'acido citrico. Il citrato di magnesio è usato come medicinale.
Il monoperoxyftalato di magnesio è un disinfettante per la disinfezione delle superfici.
Il magnesio stearato è il sale di magnesio dell'acido stearico e appartiene ai saponi di calce. È costituito da uno ione magnesio e due ioni stearato a catena lunga.
Prezzo del magnesio
Prezzi del magnesio -> prezzi dei metalli strategici
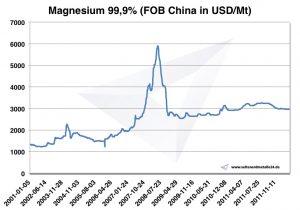
Grafico Magnesio 2001-2011













