Tantalio, Ta, numero atomico 73
Prezzo, occorrenza, estrazione e utilizzo del tantalio
Il tantalio [ˈtantalio] è un elemento chimico con il simbolo Ta e il numero atomico 73; nella tavola periodica è nel quinto sottogruppo o gruppo vanadio. È un metallo di transizione lucido, grigio grafite, raro, duttile. Il tantalio viene utilizzato principalmente per condensatori ad alta capacità e allo stesso tempo di piccole dimensioni. Poiché il metallo è atossico e inerte ai fluidi corporei, viene utilizzato anche per impianti, ad esempio come chiodo osseo.
L'elemento fu scoperto nel 1802 da Anders Gustav Ekeberg in un minerale di columbite finlandese. Ha separato un ossido molto stabile (ossido di tantalio (V)) che non si è sciolto in alcun acido. Prende il nome da Tantalo, una figura della mitologia greca. Secondo Ekeberg, la ragione di questo nome è che l'ossido molto permanente "deve languire e non può dissetarsi, come Tantalo negli inferi".
Quasi contemporaneamente, Charles Hatchett ha trovato qualcosa di molto simile in un minerale colombiano columbium. Si pensava che i due elementi fossero identici fino al 1844, quando Heinrich Rose riconobbe che due diversi elementi erano presenti nei minerali di columbite, vale a dire tantalio e colombio. Ha chiamato quest'ultimo niobio.
Dopo la scoperta del nuovo elemento, vari chimici hanno cercato di rappresentare il tantalio in forma elementare. Il primo a produrre tantalio elementare riducendo il fluoruro di tantalio con potassio fu Jöns Jakob Berzelius nel 1815. Tuttavia, come il tantalio rappresentato da Rose, il suo metallo era solo il 50% di tantalio. Nel 1902, Henri Moissan tentò di produrre tantalio in un forno elettrico, ma il carbonio che conteneva rendeva il suo prodotto molto duro e fragile.
Werner von Bolton è stato il primo a produrre tantalio puro e duttile nel 1903. Ha ottenuto questo risultato riducendo gli ossidi incandescenti nel vuoto e fondendo il metallo di tantalio impuro nel vuoto e utilizzando un arco elettrico a fiamma.
La prima applicazione del nuovo elemento è stata come filamento nelle lampadine. Il motivo del passaggio dall'osmio utilizzato in precedenza al tantalio era che è più facile da lavorare e ha una temperatura utilizzabile più alta fino a 2300 ° C. Successivamente è stato sostituito dal tungsteno, che ha un punto di fusione ancora più elevato e consente quindi uno spettro luminoso più vicino a quello della luce solare e una maggiore emissione luminosa.
Nel 1922 fu trovata una nuova applicazione per il tantalio con il suo utilizzo nei raddrizzatori e un anno dopo nei tubi radio.
Presenza
Il tantalio è un elemento raro sulla terra con un contenuto di 2 ppm nella crosta continentale e 8 ppm nel guscio terrestre. La frequenza è paragonabile a quella dell'arsenico e del germanio. All'interno del gruppo, la frequenza diminuisce di una potenza di dieci. Il tantalio non si trova naturalmente, ma solo sotto forma dei suoi composti in vari minerali. A causa della somiglianza dei due elementi, i minerali di tantalio contengono sempre niobio e viceversa (socializzazione). I minerali più importanti sono quelli della serie columbite e tapiolite, in cui vari minerali con la formula generale (Mn, Fe2+) (Nb, Ta)2O6 essere sintetizzato. I columbiti di tantalio sono anche chiamati tantalite designato. Esempi di minerali contenenti tantalio in questa serie sono la ferrotapiolite (Fe2+, Mn2+) (Ta, Nb)2O6 e manganese tantalite MnTa2O6. Questi minerali sono spesso indicati come coltan. Minerali meno comuni sono la microlite o la toreaulite.
I più importanti paesi produttori di minerali di tantalio nel 2007 sono stati l'Australia con 850 tonnellate e il Brasile con 250 tonnellate. Il coltan si trova anche in Canada e in vari paesi africani come Etiopia, Mozambico e Ruanda. I depositi nell'est della Repubblica Democratica del Congo, che furono ferocemente contestati durante la guerra del Congo 1996-2008, divennero noti nei media.
Estrazione e presentazione
Poiché il tantalio e il niobio sono sempre presenti insieme nei minerali utilizzati per l'estrazione del tantalio, devono essere separati per il recupero dei metalli puri. Ciò è complicato dalla grande somiglianza dei due elementi.
Il primo metodo di separazione fu sviluppato da Jean Charles Galissard de Marignac nel 1866. Ha usato la diversa solubilità dei due elementi in acido fluoridrico diluito. Il tantalio forma il K leggermente solubile2TaF7, Niobio il K ben solubile3NbOF5 · 2 H2O.
Il processo tecnicamente utilizzato oggi si basa sull'estrazione e utilizza la diversa solubilità di sali di fluoro complessi in acqua e alcuni solventi organici. La miscela minerale viene prima disciolta in acido fluoridrico concentrato o miscele di acido fluoridrico e solforico. I fluoruri complessi [NbOF5]2- e [TaF7]2-. Dopo che i costituenti insolubili sono stati filtrati, la separazione può essere effettuata mediante estrazione liquido-liquido con l'ausilio di metilisobutilchetone. Se si aggiunge metilisobutilchetone alla soluzione, i complessi niobio e tantalio passano nella fase organica, mentre altri elementi, come ferro o manganese, rimangono nella fase acquosa. Quando l'acqua viene aggiunta alla fase organica separata, solo il complesso di niobio si dissolve in essa, il tantalio rimane nel metilisobutilchetone.
Con l'aiuto del fluoruro di potassio, il tantalio può essere convertito in un K scarsamente solubile2[TaF7] essere abbattuto. La riduzione al tantalio elementare viene solitamente eseguita dal sodio.
![\ mathrm {K_2 [TaF_7] + 5 \ Na \ longrightarrow Ta + 5 \ NaF + 2 \ KF}](https://upload.wikimedia.org/wikipedia/de/math/4/0/8/4082df7e6f3cde8acd65ddf4230284e5.png)
Riduzione con sodio
Una possibile alternativa all'estrazione è la distillazione frazionata. A tale scopo vengono utilizzati i diversi punti di ebollizione dei due cloruri niobio pentacloruro e tantalio pentacloruro. Questi possono essere estratti dai minerali con cloro e coke ad alte temperature. Dopo la separazione, anche il cloruro di tantalio viene ridotto a metallo con sodio.
Oltre ai minerali di columbite-tantalite, le scorie della fusione dello stagno sono una fonte importante per l'estrazione del tantalio (contiene una piccola percentuale di tantalio).
Proprietà fisiche

Struttura cristallina di tantalio,a = 330,3 pm
Il tantalio è un metallo pesante ad alto punto di fusione, di colore grigio violaceo, duro come l'acciaio (durezza Vickers: 60–120 HV), simile al niobio nella maggior parte delle sue proprietà. Si cristallizza in una struttura cristallina cubica centrata sul corpo. Con un punto di fusione di circa 3000 ° C, il tantalio ha il punto di fusione più alto di tutti gli elementi dopo il tungsteno, il carbonio e il renio. Se nel metallo viene immagazzinata solo una piccola quantità di carbonio o idrogeno, il punto di fusione aumenta in modo significativo. Con un punto di fusione di 3880 ° C, il carburo di tantalio ha uno dei punti di fusione più alti di tutte le sostanze.
Il tantalio diventa un superconduttore al di sotto di una temperatura di transizione di 4,3 Kelvin.
Mentre il tantalio puro è duttile e può essere allungato considerevolmente (resistenza alla trazione: 240 MPa), anche piccole quantità di carbonio o idrogeno aggiunti cambiano significativamente la resistenza meccanica. Il materiale diventa fragile e difficile da lavorare. Questo effetto viene utilizzato per produrre polvere di tantalio. Nella tecnologia, viene caricato con idrogeno e quindi infragilito, quindi sminuzzato di conseguenza e cotto o liberato dall'idrogeno a una temperatura più elevata.
Proprietà chimiche
Il tantalio è un metallo di base e reagisce ad alte temperature con la maggior parte dei non metalli, come l'ossigeno, gli alogeni o il carbonio. A temperatura ambiente, invece, il metallo è protetto da un sottile strato di ossido di tantalio (V) e quindi passivato. Una reazione avviene solo da una temperatura di circa 300 ° C.
Nella maggior parte degli acidi il tantalio non è solubile a causa della passivazione, anche l'acqua regia non può dissolvere il metallo. Il tantalio è attaccato solo da acido fluoridrico, oleum (una miscela di acido solforico e triossido di zolfo) e sali fusi.
isotopo
Ci sono un totale di 30 isotopi e 26 isomeri di nucleo di 155Ta up 185Ta noto. Il tantalio naturale è costituito quasi esclusivamente (99,988%) dall'isotopo 181È presente anche Ta 0,012% dell'isomero del nucleo 180mTa prima. Sebbene questo possa teoricamente essere radioattivo, finora non è stato osservato alcun decadimento. L'emivita deve quindi superare 1 · 1015 essere anni.
Utilizzare
La maggior parte del tantalio (volume di produzione annuale mondiale 1.400 t) viene utilizzata per condensatori molto piccoli con alta capacità. Nel 2007, il 60% del tantalio è stato utilizzato nella produzione di condensatori. Questi condensatori elettrolitici al tantalio sono utilizzati ovunque nella moderna microelettronica, ad esempio per i telefoni cellulari e nella costruzione di automobili. L'effetto si basa sullo strato di ossido di tantalio sulla superficie del foglio di tantalio avvolto, che è ancora stabile e isolante in modo affidabile anche in una versione molto sottile. Più sottile è lo strato tra gli elettrodi, maggiore è la capacità con la stessa superficie del foglio; Inoltre, l'ossido di tantalio ha una permettività estremamente elevata, che aumenta anche la capacità.
Poiché il tantalio non è tossico e non reagisce con i tessuti o i fluidi del corpo, il tantalio elementare viene utilizzato per impianti e strumenti medici. Ad esempio, chiodi ossei, protesi, staffe e viti mascellari sono realizzati in tantalio. Inoltre, è un mezzo di contrasto per raggi X che viene utilizzato raramente a causa dei suoi costi elevati.
Nell'industria chimica, il tantalio viene utilizzato per la sua durata. Serve come materiale di rivestimento per recipienti di reazione e viene utilizzato per scambiatori di calore e pompe. Nella maggior parte dei casi, per questi scopi non viene utilizzato tantalio puro, ma leghe contenenti 2,5–10% di tungsteno. Questi sono più stabili e resistenti del tantalio puro. Allo stesso tempo, viene mantenuta la duttilità desiderata. Altri usi sono attrezzature di laboratorio, filiere e catodi di tubi elettronici. Qui il tantalio beneficia del fatto di essere in grado di assorbire fino a 800 parti in volume di gas a 740 ° C (effetto getter), il che garantisce un alto vuoto nei tubi.
Le superleghe, utilizzate nella costruzione di turbine e motori di aerei, contengono fino al 9% di tantalio. L'aggiunta del 3-4% di tantalio a una superlega di nichel aumenta la resistenza del materiale alle alte temperature.
sicurezza
La manipolazione del tantalio e dei suoi composti normalmente non causa problemi in condizioni di laboratorio. Il tantalio elementare e i composti di tantalio non sono tossici. Tuttavia, vi sono vaghe indicazioni che alcuni composti del tantalio siano cancerogeni. La polvere e la polvere di tantalio, come altri metalli finemente suddivisi, rappresentano un alto rischio di incendio ed esplosione.
Connessioni
Ossido di tantalio (V) Ta2O5 è una polvere bianca utilizzata per realizzare vetri ad alta rifrazione e materiali cristallini speciali.
Il carburo di tantalio TaC, con la sua temperatura di fusione di 3880 ° C e una durezza quasi quella di un diamante, funge da strato protettivo sulle leghe ad alta temperatura nei motori e negli utensili da taglio.
| Generale | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, simbolo, numero atomico | Tantalio, Ta, 73 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie | I metalli di transizione | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 5, 6, d | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Aspetto | grigio | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| numero CAS | 7440-25-7 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Frazione di massa del guscio di terra | 8 ppm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| nucleare | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| massa atomica | 180,9479 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio atomico (calcolato) | 145 (200) pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Raggio covalente | 138 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| configurazione elettronica | [Xe] 4f14 5d3 6s2 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1. ionizzazione | 761 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2. ionizzazione | 1500 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| fisicamente | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| stato fisico | fisso | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| struttura cristallina | cubico centrato sul corpo | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| densità | 16,65 g / cm3 (20 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| durezza Mohs | 6,5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| magnetismo | paramagnetico ( = 1,8 10-4) = 1,8 10-4) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto di fusione | 3290 K (3017 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| punto di ebollizione | 5731 K (5458 ° C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molare | 10,85 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calore di vaporizzazione | 735 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| calore di fusione | 36 kJ / mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| velocità del suono | 3400 m / s su 293,15 K | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Capacità termica specifica | 140 J / (kg · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 7,61 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| conducibilità termica | 57 W / (m · K) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chimico | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| stati di ossidazione | 5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| potenziale normale | −0,81 V (½ Ta2O5 + 5 H.+ + 5 e- → Ta + 2½ H2O) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| elettronegatività | 1,5 (scala Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| isotopo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| proprietà NMR | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| sicurezza | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Prezzi del tantalio
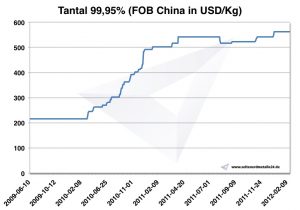
Grafico tantalio 2009-2012
Prezzi attuali del tantalio


