Cromo, Cr, numero atomico 24
Cromo - Estrazione, utilizzo, prezzi del cromo
generale
Il cromo (alt. Χρῶμα chrṓma, color ') è un elemento chimico con l'elemento simbolo Cr e il numero atomico 24. Appartiene ai metalli di transizione, nella tavola periodica è in 6. Sottogruppo (gruppo 6) o gruppo cromo. I composti del cromo hanno molti colori diversi e sono spesso usati come pigmenti nelle pitture e nelle vernici.
recupero
Il minerale di cromite estratto viene liberato dalla roccia morta. Nella seconda fase avviene una digestione ossidante a circa 1200 ° C per dare al cromato:
Il cromato di sodio viene estratto con acqua calda e convertito in bicromato con acido solforico:
Il bicromato di sodio si cristallizza per raffreddamento sotto forma di diidrato dalla soluzione. Una successiva riduzione con carbonio fornisce ossido di cromo (III):
Segue la riduzione alluminotermica dell'ossido di cromo (III) a cromo:
Il cromo non può essere ottenuto dai minerali ossidici mediante riduzione con carbone, poiché questo crea carburo di cromo. Il cromo più puro si ottiene mediante elettrodeposizione del Cr3+Ioni dalla soluzione di acido solforico mostrata. Le soluzioni corrispondenti vengono preparate sciogliendo ossido di cromo (III) o ferrocromo in acido solforico. Tuttavia, il ferrocromo come materiale di partenza richiede una separazione preliminare del ferro.
Il cromo estremamente puro viene prodotto da ulteriori fasi di purificazione utilizzando il processo van-Arkel-de-Boer.
Il ferrocromo viene prodotto riducendo la cromite in un forno ad arco elettrico a 2800 ° C.
Proprietà
Il cromo è un metallo duro bianco-argento, resistente alla corrosione e all'appannamento, resistente, malleabile e malleabile nel suo stato originale. È antiferromagnetico con una temperatura di Néel di 475 K., Il cromo si dissolve in acido cloridrico e acido solforico dopo qualche tempo con l'evoluzione dell'idrogeno quando lo strato protettivo di ossido è andato. I livelli comuni di ossidazione del cromo sono +2, +3 e +6, dove +3 è il più persistente.
Cr (II) è d4-Configurazione instabile. Non c'è quasi nessun altro agente riducente che assorba l'ossigeno dall'aria così rapidamente come il Cr (II). Ma anche senza ingresso aereo, Cr2+-Le soluzioni sono stabili solo per breve tempo se ottenute dal cromo più puro (es. Cromo elettrolitico).
Cr3+ è la forma più stabile. Ciò è spiegato dalla teoria del campo cristallino, secondo la quale il d3 La configurazione è stabilizzata da un guscio inferiore riempito per metà.
Cr (VI) come cromato (CrO42-) o dicromato (Cr2O72-) è usato come un forte agente ossidante. È tossico e cancerogeno. Nelle soluzioni acquose, c'è un equilibrio chimico tra i due ioni che dipende dal pH. Se acidifichi una soluzione diluita di cromato giallo, dai H.+-Ioni, secondo LeChatelier, l'equilibrio si sposta nella direzione del bicromato, la soluzione diventa arancione.

- Istruzioni di sicurezza e significato biologico
Il ruolo di Cr (III) (Cr3+Ioni) nel corpo umano è attualmente oggetto di controversia. Ci sono indicazioni che il Cr (III) potrebbe avere un ruolo nel metabolismo dei carboidrati e dei grassi dei mammiferi. Queste informazioni sono attualmente oggetto di follow-up. Indizi precedenti che il popolare integratore alimentare Cr (III) -picolinato ha un effetto benefico sulla struttura corporea non hanno potuto essere confermati in studi successivi. Uno studio con cellule di criceto ha dimostrato che il Cr (III) picolinato è mutageno e può provocare il cancro.
I dati attualmente disponibili indicano che è estremamente improbabile che soffra di una carenza di cromo. Dosi ancora più elevate di Cr (III) innescano con difficoltà un effetto tossico, poiché il prodotto di solubilità dell'idrossido di Cr (III) è estremamente basso (6,7 x 10-31). È quindi presumibilmente molto difficile da assorbire nell'intestino umano. Negli Stati Uniti, il livello di assunzione raccomandato di Cr (III) è stato ridotto da 50-200 µg / giorno a 35 µg / giorno negli uomini adulti ea 25 µg / giorno nelle donne adulte.
I composti di Cr (VI) sono estremamente tossici. Sono mutageni e danneggiano il DNA. Entrano nel corpo attraverso le vie aeree e danneggiano il tessuto polmonare. Le persone cronicamente esposte a tali composti corrono un rischio maggiore di sviluppare il cancro ai polmoni. L'effetto velenoso aumenta con l'insolubilità del sale. La direttiva RoHS limita fortemente l'uso dei composti di Cr (VI) in Europa.
Utilizzare
I composti di cromo e cromo sono utilizzati in un'ampia varietà di applicazioni in cui viene utilizzata la sua durabilità:
- cromatura dura: applicazione galvanica di uno strato di protezione antiusura fino a 1 mm di spessore direttamente su acciaio, ghisa, rame. L'alluminio può anche essere cromato dopo l'applicazione di uno strato intermedio (cilindri in alluminio cromato duro nella costruzione del motore).
- Dekorverchromung: applicazione galvanica di uno strato di Cr di spessore <1 μm come decorazione con uno strato intermedio anticorrosione in nichel o nichel-rame. Anche le parti in plastica sono molto spesso cromate. Il processo acrolito sostituisce la cromatura decorativa.
- passivazione strati di zinco galvanico (cromatura)
- elemento di lega: in acciaio inossidabile resistente alla corrosione e al calore e leghe non ferrose
- Catalizzatore: per abilitare o accelerare le reazioni chimiche
- concia al cromo: il metodo principale di produzione della pelle
Connessioni
- ossido di cromo
- Ossido di cromo (III) Cr2O3, è usato come vernice a smalto e per colorare il vetro (bottiglie verdi) (anche il ponte di Colonia verde). Questo non deve essere confuso con il tossico verde cromo.
- giallo cromo
- Cromato di piombo (II) PbCrO4, utilizzato per essere utilizzato come pigmento di colore giallo brillante ("Postgelb"). A causa della sua tossicità, ora è quasi completamente sostituito da pigmenti colorati organici. In analisi viene utilizzato per la determinazione iodometrica del piombo.
Il giallo cromo, che viene utilizzato come vernice per artisti, è un solfato di piombo / cromato di piombo (circa 2 PbSO4 · PbCrO4). Il pigmento fu scoperto da Louis-Nicolas Vauquelin nel 1809 ed è stato prodotto commercialmente in Germania dal 1820. Il giallo cromo ha un alto potere coprente, la sua stabilità alla luce dipende dalla tonalità del giallo. Il giallo cromo è usato raramente nella pittura a olio. Vincent van Gogh, tuttavia, ha utilizzato il giallo cromo a. un. nei famosi dipinti di girasole eseguiti ad olio su tela. Oggi, tuttavia, alcuni di questi soffrono di scolorimento dei toni gialli.
Il tecnologo d'arte Prof. Christoph Krekel dell'Accademia d'arte di Stoccarda sull'uso del pigmento giallo cromo: "I pittori sono caduti sul giallo cromo, perché è un giallo molto brillante - ha una grande intensità di colore, cioè potresti creare un dipinto molto più luminoso con l'aiuto di questa nuova tonalità gialla".
Il giallo cromo è anche un colore importante nell'analisi della contraffazione di "vecchi" dipinti.
- diossido di cromo
- Ossido di cromo (IV) CrO2, è una polvere ferromagnetica nera per la produzione di nastri magnetici con un migliore rapporto segnale-rumore rispetto ai nastri magnetici di ossido di ferro convenzionali perché il biossido di cromo ha una coercitività maggiore.
- acido cromico
- con l'ipotetica struttura H2CrO4 esiste solo in soluzione acquosa diluita. È molto velenoso. Esiste come anione in alcuni cromati e bicromati.
L'anidride dell'acido cromico, l'ossido di cromo (VI) molto velenoso CrO3, è noto come triossido di cromo.
L'arancia, molto velenoso bicromato di potassio K2Cr2O7 è un potente agente ossidante: in una soluzione di acido solforico, gli alcoli primari vengono facilmente convertiti nelle rispettive aldeidi, che possono essere utilizzate per la rilevazione semiquantitativa dell'alcol nel respiro. Nell'area del laboratorio aveva la forma di acido cromico utilizzato per la pulizia di oggetti di vetro. Al contatto con gli ioni cloruro, tuttavia, il volatile, cancerogeno cromile CrO2Cl2 formato (deduzione!). Il dicromato di potassio è anche usato come titolante e come fissativo nei bagni di tintura industriali. Bicromato di potassio e anche molto velenoso dicromato di ammonio (NH4)2Cr2O7 sono la sostanza fotosensibile negli strati di gelatina al cromo nelle prime fotografie (vedi processo di stampa fine).
- cromite
- (Mattone di ferro cromato, vedi sopra) FeCr2O4 è usato per fare stampi per bruciare mattoni.
Prezzi, grafici e dati storici del cromo
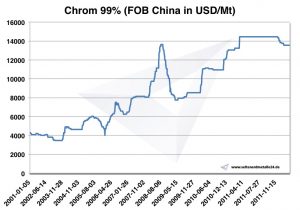
Grafico Chrome 2001-2011








 = 3,1 10-4)
= 3,1 10-4)


