Indio, In, numero atomico 49
Prezzo dell'indio, occorrenza, estrazione e uso
Generale
L'indio è un elemento chimico con il simbolo In e il numero atomico 49. Nella tavola periodica degli elementi è nel 5 ° periodo ed è il quarto elemento del 3 ° gruppo principale (gruppo 13 secondo il nuovo conteggio) o gruppo del boro. L'indio è un metallo pesante raro, bianco argenteo e morbido. La sua abbondanza nella crosta terrestre è paragonabile a quella dell'argento. L'indio non è essenziale per il corpo umano, né sono noti effetti tossici. La maggior parte del metallo viene ora trasformata in ossido di indio e stagno, che viene utilizzato come conduttore trasparente per schermi piatti e touch screen. Dall'inizio del millennio, l'aumento della domanda associato ha portato a un aumento significativo dei prezzi dell'indio e a discussioni sulla gamma dei depositi.
L'indio fu scoperto nel 1863 dai chimici tedeschi Ferdinand Reich e Theodor Richter alla Bergakademie Freiberg. Hanno esaminato un campione di sfalerite trovato nella zona per il tallio. Invece delle linee di tallio previste, hanno trovato una linea spettrale blu indaco precedentemente sconosciuta nello spettro di assorbimento e quindi un elemento precedentemente sconosciuto. Il nuovo elemento è stato successivamente chiamato dopo questo. Poco tempo dopo furono inizialmente in grado di produrre cloruro di indio e ossido, e il metallo riducendo l'ossido di indio con idrogeno. Una grande quantità di indio fu mostrata per la prima volta all'Esposizione Mondiale di Parigi nel 1867.
Dopo il suo primo utilizzo nel 1933 come componente di lega nell'oro dentale, l'ampio uso dell'indio iniziò con la seconda guerra mondiale. Gli Stati Uniti lo hanno utilizzato come rivestimento in cuscinetti di aeromobili altamente sollecitati. Dopo la seconda guerra mondiale, l'indio è stato utilizzato principalmente nell'industria elettronica, come materiale di saldatura e in leghe a basso punto di fusione. Anche l'uso nelle barre di controllo dei reattori nucleari è diventato importante con il crescente utilizzo dell'energia nucleare. Ciò ha portato al primo forte aumento del prezzo dell'indio nel 1980. Tuttavia, dopo l'incidente del reattore di Three Mile Island, sia la domanda che il prezzo sono diminuiti in modo significativo.
Dal 1987 sono stati sviluppati due nuovi composti di indio, il fosfuro di indio semiconduttore e l'ossido di stagno e indio trasparente, che è conduttivo e trasparente in strati sottili. L'ossido di indio e stagno, in particolare, è diventato tecnicamente interessante con lo sviluppo di schermi a cristalli liquidi. A causa dell'elevata domanda, la maggior parte dell'indio è stata trasformata in ossido di indio e stagno dal 1992.
Presenza
L'indio è un elemento raro, la sua quota nella crosta continentale è di soli 0,05 ppm. Ha quindi una frequenza simile a quella dell'argento e del mercurio. Allo stato solido, l'indio è stato trovato solo in un singolo ritrovamento nella Siberia orientale. Si conoscono solo pochi minerali di indio. Si tratta principalmente di minerali solforici come Indit FeIn2S4 e Roquésit CuInS2. Tuttavia, questi sono rari e non svolgono un ruolo nell'estrazione dell'indio. I maggiori depositi di indio si trovano nei minerali di zinco, in particolare nella sfalerite. Le riserve teoriche sono stimate in 16.000 tonnellate, di cui circa 11.000 tonnellate economicamente recuperabili. I depositi più grandi si trovano in Canada, Cina e Perù. I minerali contenenti indio si trovano anche in Australia, Bolivia, Brasile, Giappone, Russia, Sud Africa, Stati Uniti, Afghanistan e alcuni paesi europei. In Germania ci sono depositi nei Monti Metalliferi (Freiberg, Marienberg, Geyer) e sul Rammelsberg nei monti Harz.
Estrazione e presentazione
L'indio si ottiene quasi esclusivamente come sottoprodotto della produzione di zinco o piombo. L'estrazione economica è possibile se l'indio si accumula in determinati punti del processo di produzione. Questi includono le polveri di combustione che vengono generate durante la tostatura del solfuro di zinco e i residui che vengono lasciati durante l'elettrolisi durante il processo a umido della produzione di zinco. Questi vengono fatti reagire con acido solforico o acido cloridrico e quindi portati in soluzione. Poiché la concentrazione di indio nell'acido è troppo bassa, deve essere arricchita. Questo viene fatto, ad esempio, mediante estrazione con tributil fosfato o precipitazione come fosfato di indio.
La produzione vera e propria dell'indio avviene elettroliticamente. Per questo viene utilizzata una soluzione di cloruro di indio (III) in acido cloridrico. Questo viene convertito in indio elementare con l'aiuto di elettrodi di mercurio. Durante l'elettrolisi, bisogna fare attenzione che la soluzione non contenga più tallio, poiché i potenziali standard dei due elementi sono molto simili.

Il prodotto grezzo può essere ulteriormente purificato mediante processi adatti come processi di fusione a zona o elettrolisi ripetuta di fusi di sale di cloruro di indio (I) e quindi si può ottenere oltre il 99,99% di indio puro.
Produzione
La produzione primaria (produzione di mine) di indio era tra 2006 nell'anno 500 e 580 tonnellate. A causa delle scarse riserve naturali di 11.000 tonnellate e dell'elevata domanda, l'indio è una delle materie prime più scarse sulla terra. Nel 2008, le informazioni sulle riserve naturali di indio per la Cina in particolare sono cresciute da 280 a 8.000 tonnellate, il che ha aumentato il range statico da 6 a 19 anni. La produzione secondaria, cioè il riciclaggio, supera la produzione primaria ed era di 2008 tonnellate nel 800.
La produzione di indio in Cina è aumentata solo di recente. Nel 1994 la quantità prodotta era di 10 tonnellate. Da allora, la quota della Cina della produzione mondiale è aumentata al 60% nel 2005. La produzione in altri paesi come Giappone, Canada o Francia ha potuto essere aumentata solo in piccola parte o ridotta a causa dell'esaurimento dei depositi. Nel 2006, ad esempio, la miniera giapponese Toyoha è stata chiusa, riducendo così in modo significativo la produzione.
Poiché la domanda di indio è aumentata più rapidamente della produzione, il prezzo dell'indio è aumentato bruscamente da $ 97 nel 2002 a $ 827 per chilogrammo nel 2005. L'indio viene riciclato principalmente riutilizzando i residui dello sputtering. L'unico paese che attualmente sta recuperando indio in grandi quantità è il Giappone.
Se la domanda continua ad aumentare e il prezzo aumenta, il riciclaggio dei materiali con solo una piccola quantità di indio diventerà redditizio. Allo stesso modo, ha senso economicamente sfruttare minerali con contenuto di indio inferiore. Ciò probabilmente consentirà di ritardare l'essiccamento delle risorse.
L'indio può essere sostituito da altre sostanze nella maggior parte delle applicazioni, ma questo spesso peggiora le proprietà del prodotto o la redditività della produzione. Ad esempio, il fosfuro di indio può essere sostituito dall'arseniuro di gallio e sono possibili alcuni sostituti dell'ossido di indio e stagno, anche se di qualità inferiore.
Proprietà
Proprietà fisiche
| sistema di cristallo | tetragonale |
| gruppo spaziale |  |
| parametri reticolari
(Cella Unit) |
a = (b) = 325 pm
c = 495 pm |
| Numero (Z) di
unità di formula |
Z = 2 |

Cella unitaria di indio con ambiente di coordinazione dell'atomo di indio centrale

Poliedro di coordinazione di un atomo di indio composto da 4 + 8 = 12 atomi vicini a forma di cubottaedro distorto
L'indio è un metallo bianco-argenteo con un basso punto di fusione di 156,5985 ° C. Dei metalli, solo il mercurio, il gallio e la maggior parte dei metalli alcalini hanno un punto di fusione inferiore. Il metallo è liquido in un intervallo molto ampio di quasi 2000 K. L'indio liquido lascia permanentemente un film sottile sul vetro (bagnante). Il gallio simile ha la stessa proprietà.
Il metallo ha un'elevata duttilità e una durezza molto bassa (durezza Mohs: 1,2). È quindi possibile tagliare l'indio come il sodio con un coltello. Allo stesso tempo, lascia una linea visibile sulla carta. L'indio è superconduttore al di sotto di una temperatura di transizione di 3,41 Kelvin. Una particolarità dell'indio, che ha in comune con lo stagno, sono i caratteristici rumori che si possono sentire quando l'indio viene piegato (“urla del peltro”).
Si conosce solo una modificazione cristallina dell'indio in condizioni normali, quella nel sistema cristallino tetragonale nel gruppo spaziale  e quindi in una griglia tetragonale centrata sul corpo con i parametri della griglia a = 325 pm e c = 495 pm e due unità formula cristallizzano nella cella unitaria.
e quindi in una griglia tetragonale centrata sul corpo con i parametri della griglia a = 325 pm e c = 495 pm e due unità formula cristallizzano nella cella unitaria.
Un atomo di indio è circondato da altri dodici atomi nella struttura cristallina, quattro dei quali provengono dalle celle unitarie vicine e sono più vicini (325 pm; legami rossi) degli otto atomi situati agli angoli della cella unitaria (337 pm; legami verdi). Il numero di coordinazione 4 + 8 = 12 risulta in un cubottaedro distorto come poliedro di coordinazione. La struttura cristallina può quindi essere descritta come un impacchettamento cubico più vicino distorto tetragonalmente di sfere.
Negli esperimenti ad alta pressione, è stata scoperta un'altra modifica che è stabile sopra i 45 GPa e nel sistema cristallino ortorombico nel gruppo spaziale Fmmm cristallizzato.
Proprietà chimiche
Le proprietà chimiche dell'indio sono simili a quelle dei suoi vicini di gruppo gallio e tallio. Come gli altri due elementi, l'indio è un elemento di base che può reagire con molti non metalli ad alte temperature. Nell'aria è stabile a temperatura ambiente perché, come l'alluminio, si forma uno strato denso di ossido, che protegge il materiale da ulteriori ossidazioni per passivazione. La reazione all'ossido di indio (III) avviene solo ad alte temperature.
Mentre l'indio è attaccato da acidi minerali come acido nitrico o acido solforico, non è solubile in acqua calda, alcali e la maggior parte degli acidi organici. Anche l'acqua salata non attacca l'indio. L'indio è il metallo più solubile in mercurio a temperatura ambiente.
isotopo
Ci sono 38 diversi isotopi e altri 45 isomeri core dell'indio 97In 135In noto. In natura sono presenti solo due isotopi, 113In (64 neutroni) con il 4,29% e 115In (66 neutroni) con una quota del 95,71% nella distribuzione naturale degli isotopi. L'isotopo comune 115In è debolmente radioattivo, è un emettitore beta con un'emivita di 4,41 · 1014 Anni. Entrambi gli isotopi naturali possono essere rilevati con l'aiuto della spettroscopia NMR. Gli isotopi artificiali più stabili 111In e 114mAvere emivite di diversi giorni, 113mIn solo circa un'ora e mezza. 111In e 113mIn sono utilizzati nella medicina nucleare.
Utilizzare
Metallo

Il filo di indio è utilizzato nelle guarnizioni di indio.
L'indio è versatile, ma il suo utilizzo è limitato dalla sua rarità e dal prezzo elevato. La maggior parte dell'indio prodotto non viene utilizzato come metallo, ma viene trasformato in una serie di composti. Per la produzione del solo ossido di indio e stagno, nel 2000 è stato utilizzato il 65% della produzione totale di indio. Dall'indio prodotto si ottengono anche altri composti come il fosfuro di indio e l'arseniuro di indio. Maggiori dettagli sull'uso dei composti di indio possono essere trovati nella sezione Connessioni.
I pezzi metallici possono essere protetti da rivestimenti di indio depositati galvanicamente. I materiali in acciaio, piombo o cadmio, ad esempio, rivestiti in questo modo sono più resistenti alla corrosione da acidi organici o soluzioni saline e, soprattutto, all'abrasione. In passato, gli strati protettivi di indio venivano spesso utilizzati per i cuscinetti di scorrimento di automobili o aerei. Tuttavia, a causa del forte aumento del prezzo dell'indio, questo non è più economico. Le superfici rivestite di indio hanno una riflettanza elevata e uniforme su tutti i colori e possono quindi essere utilizzate come specchio.
Il punto di fusione dell'indio è relativamente basso e può essere determinato in modo molto preciso. Per questo motivo è uno dei punti fissi quando si imposta la scala della temperatura. Questa proprietà viene utilizzata anche per la calibrazione nella calorimetria differenziale dinamica (DSC).
A causa della grande sezione trasversale di cattura sia per i neutroni lenti che per quelli veloci, l'indio è un materiale adatto per le barre di controllo nei reattori nucleari. Le lamine di indio possono essere utilizzate anche come rivelatori di neutroni. L'indio è a tenuta di gas e facile da deformare anche a basse temperature ed è quindi utilizzato nelle cosiddette guarnizioni di indio nei criostati.
L'indio svolge anche un ruolo di saldatura per molti materiali a causa di alcune proprietà speciali. Si deforma solo leggermente quando si raffredda. Ciò è particolarmente importante quando si saldano semiconduttori per transistor. Anche il fatto che l'indio sia in grado di saldare materiali non metallici come il vetro e la ceramica gioca un ruolo.
Con le "pillole di indio", le piastrine di germanio sono state legate su entrambi i lati per produrre i primi transistor.
leghe
L'indio può essere legato con molti metalli. Molte di queste leghe, specialmente con i metalli bismuto, stagno, cadmio e piombo, hanno un basso punto di fusione da 50 a 100 ° C. Ciò si traduce, ad esempio, in possibili applicazioni in sistemi sprinkler, termostati e fusibili. Poiché il piombo, che può anche essere utilizzato, è velenoso, l'indio funge da sostituto innocuo. Lo scopo di queste leghe è che fondono quando la temperatura ambiente è troppo alta, a causa del fuoco o delle correnti elevate. La fusione quindi interrompe il circuito o attiva il sistema di irrigazione. Le leghe di indio-gallio hanno spesso punti di fusione ancora più bassi e sono contenute in termometri ad alta temperatura. Una lega speciale di gallio-indio-stagno è il Galinstan. È liquido a temperatura ambiente e funge da innocuo sostituto del mercurio o delle leghe sodio-potassio.
Esistono molte altre leghe contenenti indio che vengono utilizzate in diverse aree. L'indio viene utilizzato con rame, manganese e magnesio come componente di lega nei materiali magnetici. Occasionalmente l'indio (massimo 5%) con argento, stagno, rame, mercurio e zinco viene utilizzato come miscela nelle otturazioni in amalgama. Lo strato di memoria di un CD-RW contiene indio, tra le altre cose.
prova
Una possibile prova chimica è la precipitazione di ioni indio con l'aiuto di 8-idrossichinolina da soluzione di acido acetico. Normalmente, l'indio non viene rilevato con mezzi chimici, ma con metodi spettroscopici adeguati. L'indio può essere facilmente rilevato utilizzando le caratteristiche righe spettrali a 451,14 nm e 410,18 nm. Poiché questi sono nella gamma spettrale del blu, risulta il tipico colore della fiamma blu. L'analisi della fluorescenza a raggi X e la spettrometria di massa sono disponibili come metodi di esame per una determinazione quantitativa più precisa.
Tossicità e sicurezza
Sebbene non sia noto che l'indio metallo abbia effetti tossici, è stato dimostrato che gli ioni di indio hanno effetti embrionali e teratogeni negli esperimenti su animali con ratti e conigli. Con una singola dose di 0,4 mg * kg-1 InCl3 Malformazioni come palatoschisi e oligodattilia sono state osservate in ratte gravide. Questi fenomeni sono stati riscontrati più frequentemente quando l'indio è stato applicato il 10 ° giorno di gravidanza. Al contrario, non sono state osservate malformazioni nei topi. Il nitrato di indio è risultato tossico per gli organismi acquatici (tossicità acquatica).
Il metallo indio compatto non è infiammabile. Allo stato finemente suddiviso come polvere o polvere, invece, come molti metalli, è altamente infiammabile e combustibile. L'indio che brucia non deve essere spento con acqua a causa del rischio di esplosione dell'idrogeno prodotto, ma deve essere spento con estintori metallici (classe D).
Connessioni
L'indio forma una serie di composti. In essi, il metallo di solito ha lo stato di ossidazione + III. Il livello + I è più raro e più instabile. Lo stato di ossidazione + II non esiste, i composti in cui si manifesta l'indio formalmente bivalente sono in realtà composti misti di indio monovalente e trivalente.
indio
L'ossido di indio (III) è un sale giallo stabile. L'ossido di indio (III) puro è usato raramente; nella tecnologia, la maggior parte di esso viene ulteriormente trasformato in ossido di indio e stagno. È ossido di indio (III) drogato con una piccola quantità di ossido di stagno (IV). Questo trasforma la connessione in un ossido trasparente e conduttivo (materiale TCO). Questa combinazione di proprietà, che solo pochi altri materiali hanno, lo rende ampiamente utilizzato. L'ossido di indio e stagno è utilizzato in particolare come conduttore in schermi a cristalli liquidi (LCD), diodi organici a emissione di luce (OLED), schermi tattili e celle solari. In altre applicazioni come i finestrini delle automobili riscaldati e le celle solari, il costoso ossido di indio e stagno potrebbe essere sostituito da un più economico ossido di zinco drogato con alluminio.
semiconduttori composti
Molti composti di indio sono semiconduttori composti con caratteristici intervalli di banda. Ciò vale in particolare per i composti con elementi del 15 ° e 16 ° gruppo principale, come fosforo, arsenico o zolfo. Quelli con elementi del 15 ° gruppo principale sono contati tra i semiconduttori composti III-V, quelli con calcogeni tra i semiconduttori composti III-VI. Il numero dipende dal numero di elettroni di valenza nei due componenti di collegamento. Il nitruro di indio, il fosfuro di indio, l'arseniuro di indio e l'antimonuro di indio hanno applicazioni diverse in diodi diversi, come diodi a emissione di luce (LED), fotodiodi o diodi laser. L'applicazione esatta dipende dal band gap richiesto. Solfuro di indio (III) (In2S3) è un semiconduttore III-VI con un intervallo di banda di 2 eV, utilizzato al posto delle celle solari sulfidina di cadmio. Alcuni di questi composti, in particolare il fosfuro di indio e l'arseniuro di indio, svolgono un ruolo nella nanotecnologia. I nanofili di fosfuro di indio hanno una fotoluminescenza fortemente anisotropa e possono essere eventualmente utilizzati in fotorilevatori o interruttori ottici altamente sensibili.
Oltre ai semiconduttori composti semplici, ci sono anche composti semiconduttori che contengono più di un metallo. Un esempio è l'arseniuro di gallio indio (InxGa1-xAs) un semiconduttore ternario con un band gap ridotto rispetto all'arseniuro di gallio. Diseleniuro di rame e indio (CuInSe2) ha un alto grado di assorbimento della luce ed è quindi utilizzato nelle celle solari a film sottile (celle solari CIGS).
Ulteriori composti di indio
L'indio forma una serie di composti con gli alogeni fluoro, cloro, bromo e iodio. Sono acidi di Lewis e formano complessi con donatori idonei. Un importante alogenuro di indio è il cloruro di indio (III). Questo viene utilizzato, tra l'altro, come catalizzatore per la riduzione dei composti organici.
Esistono anche composti organici di indio con le formule generali InR3 e InR. Come molti composti organometallici, sono sensibili all'ossigeno e all'acqua. I composti organici di indio sono usati come reagenti droganti nella produzione di semiconduttori.
| Generale | ||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Nome, simbolo, numero atomico | Indio, In, 49 | |||||||||||||||||||||||||||||||||
| Serie | metalli | |||||||||||||||||||||||||||||||||
| Gruppo, periodo, blocco | 13, 5, p | |||||||||||||||||||||||||||||||||
| Aspetto | grigio argenteo lucido | |||||||||||||||||||||||||||||||||
| numero CAS | 7440-74-6 | |||||||||||||||||||||||||||||||||
| Frazione di massa del guscio di terra | 0,1 ppm | |||||||||||||||||||||||||||||||||
| nucleare | ||||||||||||||||||||||||||||||||||
| massa atomica | 114,818 u | |||||||||||||||||||||||||||||||||
| Raggio atomico (calcolato) | 155 (156) pm | |||||||||||||||||||||||||||||||||
| Raggio covalente | 144 pm | |||||||||||||||||||||||||||||||||
| Van der Waals raggio | 193 pm | |||||||||||||||||||||||||||||||||
| configurazione elettronica | [Kr] 4d105s25p1 | |||||||||||||||||||||||||||||||||
| 1. ionizzazione | 558,3 kJ / mol | |||||||||||||||||||||||||||||||||
| 2. ionizzazione | 1820,7 kJ / mol | |||||||||||||||||||||||||||||||||
| 3. ionizzazione | 2704 kJ / mol | |||||||||||||||||||||||||||||||||
| fisicamente | ||||||||||||||||||||||||||||||||||
| stato fisico | fisso | |||||||||||||||||||||||||||||||||
| struttura cristallina | tetragonale | |||||||||||||||||||||||||||||||||
| densità | 7,31 g / cm3 | |||||||||||||||||||||||||||||||||
| durezza Mohs | 1,2 | |||||||||||||||||||||||||||||||||
| magnetismo | diamagnetico ( = -5,1 10-5) = -5,1 10-5) |
|||||||||||||||||||||||||||||||||
| punto di fusione | 429,7485, K (156,5985 ° C) | |||||||||||||||||||||||||||||||||
| punto di ebollizione | 2345 K (2072 ° C) | |||||||||||||||||||||||||||||||||
| Volume molare | 15,76 · 10-6 m3/ mol | |||||||||||||||||||||||||||||||||
| Calore di vaporizzazione | 231,8 kJ / mol | |||||||||||||||||||||||||||||||||
| calore di fusione | 3,26 kJ / mol | |||||||||||||||||||||||||||||||||
| pressione di vapore | 1 Pa a 1196 K. | |||||||||||||||||||||||||||||||||
| velocità del suono | 1215 m / s su 293,15 K | |||||||||||||||||||||||||||||||||
| Capacità termica specifica | 233 J / (kg · K) | |||||||||||||||||||||||||||||||||
| Conducibilità elettrica | 12,5 · 106 A / (V · m) | |||||||||||||||||||||||||||||||||
| conducibilità termica | 81,6 W / (m · K) | |||||||||||||||||||||||||||||||||
| Chimico | ||||||||||||||||||||||||||||||||||
| stati di ossidazione | 3, 1 | |||||||||||||||||||||||||||||||||
| potenziale normale | −0,343 V (In3+ + 3e- → In) | |||||||||||||||||||||||||||||||||
| elettronegatività | 1,78 (scala Pauling) | |||||||||||||||||||||||||||||||||
| isotopo | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| proprietà NMR | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
| sicurezza | ||||||||||||||||||||||||||||||||||
|
||||||||||||||||||||||||||||||||||
Prezzo dell'indio
Prezzi dell'indio -> Prezzi dei metalli strategici
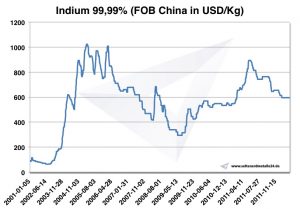
Grafico Indio 2001-2011



