Tellurio, Te, numero atomico 52
Prezzo, occorrenza, estrazione e uso del tellurio
Il tellurio [tʰɛluːɐ̯] (latino tellus "terra") è un raro elemento chimico con l'elemento simbolo Te e il numero atomico 52. Nella tavola periodica è nel sesto gruppo principale, o 16. Gruppo IUPAC e 5. Periodo ed è uno dei Chalkogens. La sua frequenza è simile a quella dell'oro, con la quale entra anche in vari composti che si presentano in natura come minerali. Il tellurio cristallino è un semimetallo metallico bianco argenteo e lucido che ricorda l'aspetto di stagno e antimonio. Reagisce fragile allo stress meccanico e può quindi essere facilmente polverizzato. Nei composti chimici con non metalli ha un comportamento vicino allo zolfo e al selenio, nelle leghe e nei composti intermetallici, tuttavia mostra proprietà (semi) metalliche molto pronunciate.
Storia
Tellurium era 1782 del chimico e mineralogista austriaco Franz Joseph Mueller von Reichenstein (1740-1825) nelle indagini sui minerali d'oro della miniera Mariahilf sul monte Faczebaja a Zlatna (Klein Schlatten, Zalatna) vicino a Sibiu (tedesco Hermannstadt , Transilvania, Romania), che ha prodotto meno oro del previsto. Si era reso conto dei minerali del trattato scientifico di Ignaz von Born (1742-1791) sulla spiata Spiesglaskönig in Transilvania. Spiesglaskönig si riferisce all'antimonio solido, il vetro Spies è un vecchio nome per il minerale Antimonit (Stibnit, fusione di Grauss Sb2S3). Von Born ha mantenuto il metallo solido nel minerale d'oro per l'antimonio e ha attribuito la bassa resa a una combinazione dell'oro con l'antimonio. Mueller von Reichenstein ha contraddetto questo punto di vista e lo ha sostenuto per "bismuto solforato". Dopo ulteriori indagini, i cui risultati ha pubblicato tra 1783 e 1785 in un saggio in quattro parti, ma ha anche escluso il bismuto, poiché il metallo, in contrasto con l'antimonio e il bismuto, praticamente non ha reagito con l'acido solforico. Diede alla fase metallica il nome metallum problematicum (anche aurum problematicum o aurum paradoxum). Secondo le attuali conoscenze, accanto al solido tellurio dei minerali Nagyágit (minerale di foglie, AuPb (Pb, Sb, Bi) Te2-3S6) e Sylvanite (font, (Au, Ag) Te2). Mueller von Reichenstein ha suggerito che il metallum problematicum "... forse un nuovo semi-metallo non ancora riconosciuto", ha voluto tuttavia confermare le sue scoperte solo dal mineralogista e chimico svedese Torben Olof Bergman (1735-1784). Nell'anno 1783, ha inviato campioni del minerale a Bergman per la revisione, ma non ha ricevuto risposte definitive. Bergman è morto 1784 e le indagini sul metallum problematicum sono state sospese per il momento.
Solo dodici anni dopo, nell'anno 1797, Martin Heinrich Klaproth (1743-1817) ricevette campioni dei minerali da Müller von Reichenstein a Berlino. Klaproth ha affermato le conclusioni delle indagini di Müller von Reichenstein e ha visto prove sufficienti per la scoperta di un nuovo elemento. A gennaio 1798 Klaproth ha elogiato i meriti Müller von Reichenstein in una conferenza e gli ha attribuito la scoperta del nuovo elemento. Poiché Mueller von Reichenstein non aveva dato all'elemento nessun nome, Klaproth decise per il nome Tellurium (tellus latino: "terra"):
Per colmare questa lacuna nella mineralogia chimica, presento qui i miei esperimenti ed esperienze con questi minerali preziosi, il cui risultato principale è la scoperta e la validazione di un nuovo metallo peculiare, al quale aggiungo il nome Tellurium preso in prestito dalla vecchia Madre Terra. "
I manipoli originali del materiale campione della località tipo Zlatna, che Klaproth aveva a disposizione, sono oggi al Museo di Storia Naturale di Berlino.
Indipendente da Müller von Reichenstein e Klaproth, 1789 ha scoperto il chimico e botanico ungherese Paul Kitaibel (1757-1817) il tellurio nelle indagini sul minerale d'oro dal villaggio minerario Nagybörzsöny (Deutsch-Pilsen) in Ungheria. Klaproth menzionò nella sua conferenza pubblicata, tuttavia, solo Müller von Reichenstein, sebbene a partire da 1796 da un manoscritto Kitaibels fosse anche a conoscenza delle sue indagini. In una lettera a Kitaibel, Klaproth dichiarò di aver perso il contenuto del manoscritto e di non aver visto alcun legame con il suo lavoro nelle indagini del minerale Müller von Reichenstein. Alla fine, Klaproth alla fine convinse Kitaibel che la scoperta del tellurio doveva essere attribuita al solo Mueller von Reichenstein, poiché aveva fatto le stesse osservazioni sul nuovo elemento diversi anni prima.
L'elemento simbolo "Te" è stato proposto a 1814 da Jöns Jakob Berzelius (1779-1848) ed è ancora oggi utilizzato. La prima spiegazione della struttura del tellurio cristallino con diffrazione dei raggi X è stata 1924.
Presenza
Il tellurio è un elemento raro; il suo contributo alla crosta terrestre è di circa 0,01 ppm (g / t). Con l'oro, subordinato all'argento, al rame, al piombo e al bismuto, così come ai metalli di platino, raramente si presenta dignitoso, cioè in forma elementale in natura.
Il tellurio solido appartiene come minerale al gruppo di elementi, più precisamente semi e non metalli ed è nella classificazione dei minerali secondo Strunz sotto il numero I / B.03-40 (edizione 8) o 1.CC.10 (9. Edizione), e ha portato a Dana con il numero 1.3.4.2.
Tracce di maggiori quantità di selenio possono essere contenute nel tellurio solido (selenio). Sebbene il tellurio sia un elemento raro, è noto un numero relativamente grande di minerali perché il tellurio forma i suoi minerali perché è raramente incorporato in solfuri o selenidi o solfati o selenati; è troppo grande per questi reticoli cristallini di omologhi più leggeri. Al contrario, i due omologhi più leggeri rappresentano più frequentemente il tellurio nei suoi siti reticolari in strutture cristalline di minerali contenenti tellurio.
Il tellurio mostra la più alta affinità con l'oro di tutti gli elementi e pertanto si trova spesso in natura sotto forma di tellururi d'oro, minerali con tellururo (Te2) o anioni ditelluride (Te22-). Oltre all'oro e ad altri metalli preziosi il piombo e il bismuto formano tellururi più naturali, che spesso accompagnano (paragenesi) ai metalli dignitosi e ai minerali d'oro.
Più rari sono i minerali con cationi Te4 + nella struttura cristallina, per cui l'ossido più importante del tellurio, il biossido di tellurio TeO2, si presenta in due modifiche come la tellurite ortorombica e la paratellurite tetragonale in natura. Altri cationi di tellurio (IV) sono ossotellurati (IV) (telluriti) contenenti complessi [TeO3] 2 o [TeO4] 4. I minerali contenenti cationi Te6 + sotto forma di anioni complessi ottaedrici [TeO6] 6 sono estremamente rari, con minerali 21 che contengono principalmente rame e piombo. Oltre ai menzionati minerali, esistono anche minerali di tellurio misto di valenza in natura, tra cui il calcio oxo-tellurato (IV, VI) Carlfriesite CaTe3O8 con un Te4 +: Te6 + rapporto di 2: 1: [14] [15] [4] e 6] I cationi sono minerali secondari che sono sorti dall'erosione del tellurio e del tellururo.
I minerali contenenti tellurio non rivestono importanza per la produzione tecnica di tellurio, in quanto sono rari e praticamente non vi sono depositi che meritano di essere estratti. Oltre alla località tipo Zlatna (Transilvania, Romania), noti minerali ricchi di tellurio includono Moctezuma (Messico), Cripple Creek (Colorado), Kalgoorlie (Australia) e Calaveras (California). Finora (a partire da 2012) sono noti minerali contenenti tellurio 154, di cui, tuttavia, cinque (dilithium, imgreit, kurilite, sztrokayite, protojoseite) non sono ancora stati riconosciuti o screditati come minerali indipendenti dall'International Mineralogical Association (IMA).
Estrazione e presentazione
Il tellurio insieme al selenio è ottenuto industrialmente esclusivamente da sottoprodotti della produzione di rame elettrolitico su larga scala e nichel. I fanghi anodici risultanti contengono telluridi e -selenidi di metallo nobile insolubili in acqua della formula generale M2Ch (M = Cu, Ag, Au, Ch = Se, Te), che a temperature superiori a 500 ° C. sotto ossigeno atmosferico (O2) con soda (carbonato di sodio Na2CO3 ) sono reagiti. I cationi di metalli nobili (M +) sono quindi ridotti a metalli elementari (M), che ossida gli anioni telluridici in oxo-tellurati (IV) (TeO32-):
In alternativa, questa reazione può anche essere effettuata con acido nitrico (nitrato di sodio NaNO3) in assenza di aria e formazione di ossidi di azoto (NO e NO2):
Il risultante sodio tellurato (IV) Na2TeO3 viene quindi sciolto in acqua, dove reagisce in modo basilare e forma ioni idrogentellurato (IV) HTeO3-. La separazione dei tellurati (IV) dai selenati formati allo stesso modo (IV) nella soluzione di base mediante neutralizzazione con aggiunta di acido solforico (H2SO4), che precipita in acqua diossido di tellurio quasi insolubile TeO2:
Il biossido di tellurio può essere ridotto al tellurio elementare nei litchi mediante elettrolisi o mediante mezzi chimici mediante dissoluzione in acidi minerali concentrati e introduzione di biossido di zolfo SO2, lo zolfo che si forma dalle molecole SO2 (o gli ioni solfito di SOxnumx formati dalla soluzione). ) e si formano ioni solfato (SO32-):
Il processo di fusione a zone viene utilizzato per ottenere tellurio di elevata purezza (> 99,9%).
La produzione annua globale di tellurio è aumentata da 298 tonnellate in 2013 del 53% a 457 tonnellate nell'anno 2017, con una media di 382,8 tonnellate all'anno (t / a). I principali produttori includono Cina (∅ 220,0 t / a), Stati Uniti (∅ 50,0 t / a), Russia (∅ 35,6 t / a), Svezia (∅ 32,4 t / a), Giappone (∅ 31,8 t / a) e Canada (∅ 13,0 t / a). Nella tabella è riportata una panoramica delle quantità di produzione dei singoli paesi. Altre nazioni industriali, come la Germania e il Belgio, produrranno probabilmente tellurio, ma non ci sono dati disponibili. [17] L'indagine geologica degli Stati Uniti (USGS) stima che le riserve globali di tellurio in 2019 siano circa di 31.000 tonnellate.
| Paese | 2013 | 2014 | 2015 | 2016 | 2017 | ∅ |
|---|---|---|---|---|---|---|
| Cina | 150 | 180 | 210 | 279 | 281 | 220,0 |
| USA | 50 | 50 | 50 | 50 | 50 | 50,0 |
| Russia | 31 | 33 | 34 | 40 | 40 | 35,6 |
| Svezia | 24 | 31 | 33 | 39 | 35 | 32,4 |
| Giappone | 31 | 32 | 34 | 28 | 34 | 31,8 |
| Canada | 12 | 9 | 9 | 18 | 17 | 13,0 |
| ronzio | 298 | 335 | 370 | 454 | 457 | 382,8 |
 |
||||||
modifiche
Tellurio cristallino
In condizioni standard, è nota solo una modifica cristallina (Te-I o α-Te) del tellurio, che viene chiamata tellurio cristallino o metallico. È isotipico all'α-selenio, cioè ha la stessa struttura cristallina. Nel sistema cristallino trigonale nel gruppo spaziale P3121 (n. 152), il tellurio si cristallizza con i parametri reticolari a = 446 pm ec c = 592 pm e tre unità di formula nella cella unitaria (unità più piccola della struttura cristallina).
Il gruppo spaziale P3121 (n. 152), descritto secondo il simbolismo di Hermann Mauguin, spiega il centraggio della cella unitaria e gli elementi di simmetria esistenti. P significa che il reticolo di Bravais è primitivo. L'informazione sul centraggio è seguita dagli elementi di simmetria esistenti del gruppo spaziale: 31 descrive un triplice asse della vite (moltiplicazione di una particella per rotazione di 120 ° e traslazione di 1/3 nella direzione dell'asse di rotazione) parallelo all'asse c cristallografico ([001] ), 2 descrive un duplice asse di rotazione (moltiplicazione per rotazione di 180 °) parallelo ai tre assi a cristallografici (<100>), 1 l'elemento di simmetria del singolo asse di simmetria o identità (moltiplicazione per rotazione di 360 °, quindi la particella è formata su se stesso) nella direzione perpendicolare agli assi a e all'asse c (<120>).
La struttura cristallina contiene solo un atomo di tellurio distinguibile cristallograficamente con le coordinate di posizione x = 0,2636, y = 0 e z = 1 / 3. Tutti gli altri atomi della struttura cristallina possono essere attribuiti a questo atomo dagli elementi di simmetria esistenti del gruppo spaziale. Poiché l'atomo di tellurio coincide nella sua posizione con il doppio asse di simmetria del gruppo spaziale (P3121 (n. 152)), viene moltiplicato esclusivamente per l'asse triplo della vite (31). Ciò si traduce in catene elicoidali di atomi di tellurio legati in modo covalente paralleli all'asse c. Gli atomi di tellurio si trovano all'interno della catena 284 pm a parte, l'angolo di legame è 103,1 °. I collegamenti all'interno della catena sono evidenziati in rosso nelle illustrazioni, una catena è mostrata in blu per chiarezza, con l'atomo blu scuro su z = 1 / 3, il blu centrale su z = 2 / 3 e l'azzurro su z = 1 o z = 0 si trova. Ogni terzo atomo all'interno della catena è quindi congruente. Ogni catena è circondata da altre sei catene. Esistono legami di Van der Waals tra le catene con distanze Te-Te di 349 pm (mostrate in linee tratteggiate verdi), che risultano dalla caduta al di sotto del raggio di van der Waals (2 · 206 pm = 412 pm) degli atomi di tellurio , Per un singolo atomo di tellurio si ottiene un numero di coordinazione di 6, più precisamente 2 + 4, poiché gli atomi 2 provengono dalla stessa catena e quindi hanno una distanza inferiore rispetto agli altri 4 dalle catene vicine. Come poliedro di coordinazione, questo si traduce in un ottaedro distorto (evidenziato in giallo).
Il tellurio può anche cristallizzare nel gruppo spaziale P3221 (# 154) anziché P3121 (# 152). L'asse della vite 32 duplica anche un atomo ruotandolo attorno a 120 °, ma poi lo sposta di 2 / 3 anziché 1 / 3 nella direzione dell'asse di rotazione. Ciò crea anche catene elicoidali che si avvolgono in senso orario anziché antiorario (nell'asse della vite 31) lungo l'asse c. La struttura cristallina nel gruppo spaziale P3221 (n. 154) ("mano sinistra") è quindi l'immagine speculare della struttura nel gruppo spaziale P3121 (n. 152) ("forma giuridica"). La comparsa di forme cristalline a immagine speculare è chiamata enantiomorfismo nella cristallografia.
Il sistema di cristalli di tellurio viene spesso definito esagonale. Il sistema cristallino esagonale e trigonale si basa sulla stessa cellula unitaria, ma una simmetria esagonale richiederebbe la presenza di un asse di simmetria sei volte (6, moltiplicazione di una particella per rotazione attorno a 60 °). La struttura cristallina del tellurio, tuttavia, contiene solo il triplo asse della vite (31) e quindi appartiene senza dubbio al sistema trigonale simmetrico inferiore del cristallo.
In esperimenti ad alta pressione con tellurio cristallino (Te-I o α-tellurio) sono state scoperte ulteriori modifiche. Gli intervalli di pressione specificati per la stabilità delle modifiche variano in parte in letteratura:
- Te-II si cristallizza nel sistema di cristalli monoclinici nell'intervallo di pressione da 4 a 6,6 GPa. C2 / m (n. 12) e P21 (n. 4) sono citati in letteratura come possibili gruppi spaziali.
- Te-III si cristallizza nel sistema cristallino ortorombico ed è stabile nell'intervallo di pressione sopra 6,6 GPa. Per una modifica ortorombica, esiste un calcolo teorico nel gruppo spaziale Imma (n. 74).
- Te-IV si cristallizza nel sistema cristallino trigonale nel gruppo spaziale R3m (n. 166) e corrisponde alla struttura del β-polonio. È stabile nell'intervallo di pressione da 10,6 a 27 GPa. Le distanze degli atomi di tellurio all'interno delle catene e delle catene adiacenti in questa modifica sono le stesse e ciascuna ammonta a 300 pm, il che si traduce in una maggiore simmetria rispetto a α-Te.
- Te-V è stabile sopra 27 GPa. Per questa modifica, viene assunto un reticolo centrato sul corpo cubico (gruppo spaziale Im3m (# 229)).
Tellurio amorfo
La modificazione amorfa instabile è una polvere marrone e può essere preparata dall'acido tellurico (H2TeO3) mediante reazione con acido solforoso (H2SO3) o ioni solfito (SO32-). Gli ioni solfito vengono quindi ossidati in ioni solfato (SO42-) mentre i cationi Te4 + sono ridotti al tellurio elementare:
Il tellurio amorfo si converte lentamente in modificazione cristallina in condizioni standard.
Proprietà fisiche
Il tellurio cristallino è un semiconduttore intrinseco diretto con un gap di banda di 0,334 eV. Come per tutti i semiconduttori, la conducibilità elettrica può essere aumentata aumentando la temperatura o l'esposizione, ma ciò porta solo a un leggero aumento del tellurio. La conduttività elettrica e la conducibilità termica si comportano direzionalmente in dipendenza dal tellurio, cioè anisotropico. Il tellurio cristallino è un materiale morbido (Mohs 2,25) e fragile che è facile da trasformare in polvere. Aumentando la pressione, il tellurio si trasforma in ulteriori modifiche cristalline. Sopra 450 ° C, il tellurio passa in una fusione rossa e a temperature superiori a 990 ° C, il tellurio è presente come un gas diamagnetico giallo delle molecole di Te2. A temperature superiori a 2000 ° C, le molecole di Te2 si scompongono in singoli atomi.
Proprietà chimiche
Il tellurio cristallino è insolubile in acqua e scarsamente solubile negli acidi minerali acido cloridrico e acido solforico e negli alcali. D'altra parte, è molto solubile in acido nitrico, in quanto è un agente ossidante molto forte e ossida il tellurio elementare in tellurati con lo stato di ossidazione stabile + IV. Il tellurio scioglie rame, ferro e acciaio inossidabile.
Nei composti con non metalli, il tellurio si comporta come il selenio dei membri del gruppo più leggero. Nell'aria brucia in una fiamma blu foderata di verde per il biossido di tellurio TeO2:
Il tellurio reagisce spontaneamente con gli alogeni per formare alogenuri di tellurio. Sorprendentemente, a differenza degli omologhi più leggeri selenio e zolfo, il tellurio forma anche ioduri termodinamicamente stabili, incluso lo ioduro di tellurio TeI con lo stato di ossidazione + I. Con metalli di base come lo zinco, reagisce violentemente ai corrispondenti tellururi.
isotopo
Il tellurio è noto per gli isotopi numerati in serie tra 105 e 142. Il tellurio naturale è un elemento misto costituito da otto isotopi, di cui cinque (122Te, 123Te, 124Te, 125Te, 126Te) sono stabili. L'isotopo 123Te dovrebbe teoricamente decadere in 123Sb durante l'acquisizione di elettroni. Tuttavia, questo decadimento non è stato ancora osservato; il limite inferiore per la sua emivita è 9,2 · 1016 anni (92 quadrilioni di anni). L'isotopo 120Te passa direttamente a 120Sn tramite la cattura a doppio elettrone. Gli isotopi 128Te e 130Te si convertono in 128Xe e 130Xe, rispettivamente, per emissione di radiazioni beta (doppio decadimento beta).
Il principale contributo al tellurio naturale è circa un terzo dell'isotopo 130Te con un'emivita di 7,9 · 1020 anni, seguito dall'isotopo 128Te. La massa atomica media degli isotopi del tellurio naturale è quindi 127,60, che è maggiore di quella dell'iodio puro con 126,90 che segue nella tavola periodica. 128Te è considerato l'isotopo con il decadimento più lento di tutti gli isotopi non stabili di tutti gli elementi. Il decadimento estremamente lento con un'emivita di 7,2 · 1024 anni (7 quadrilioni di anni, ovvero in chilogrammi 1 un decadimento di un atomo ogni 18 mesi) poteva essere determinato solo rilevando il prodotto di decadimento (128Xe) in campioni molto vecchi di tellurio naturale.
Degli altri isotopi, l'isomero centrale 121mTe ha la più lunga emivita con i giorni 154. Anche per gli isotopi 127Te e 129Te, le emivite degli isomeri sono superiori a quelle dello stato fondamentale. Il tracciante più comunemente usato è l'isotopo 127Te, seguito da 121Te. Gli isotopi 127Te e 129Te si presentano anche come prodotti di fissione nella fissione nucleare nei reattori nucleari.
Utilizzare
Il tellurio è un elemento tecnicamente meno importante perché è costoso da produrre e altri elementi o composti sono spesso equivalenti nell'uso. Nel 2016 è stato dimostrato un comportamento termoelettrico di tellurio elementare, policristallino e drogato con una cifra di merito elevata nell'intervallo tra temperatura ambiente e 400 ° C. Il tellurio elementare è utilizzato nell'industria dei metalli come additivo (<1%) per acciaio, ghisa, rame e leghe di piombo e negli acciai inossidabili. Promuove la resistenza alla corrosione e migliora le proprietà meccaniche e la lavorabilità. Il tellurio puro è stato finora utilizzato solo raramente come semiconduttore; il tellurio è utilizzato principalmente nei semiconduttori composti II-VI. Tellururo di cadmio CdTe è z. B. utilizzato nei fotodiodi e nelle celle solari a film sottile per generare elettricità dalla luce.
Il tellururo di bismuto Bi2Te3 viene utilizzato nelle termocoppie per generare elettricità nei generatori termoelettrici (ad esempio nelle batterie al radionuclide) o negli elementi Peltier per il raffreddamento.
Le combinazioni di germanio GeTe e tellururo di antimonio Sb2Te3 sono utilizzate nei materiali a cambiamento di fase come parte dei dischi di archiviazione ottica (ad esempio CD-RW) o in nuovi materiali di archiviazione come la memoria ad accesso casuale a cambiamento di fase.
A causa dei loro alti indici di rifrazione, vengono utilizzati gli occhiali TeO2 diossido di tellurio al posto del vetro di silice SiO2 nelle guide d'onda ottiche.
In microbiologia, l'agar misto di potassio (X) K2TeO3 incolore tellurico viene utilizzato come mezzo nutritivo selettivo per la rilevazione di stafilococchi e Corynebacterium diphtheriae. Le colonie batteriche appaiono come piccole sfere nere, poiché riducono i cationi Te4 + al tellurio elementare e li immagazzinano nelle loro cellule.
Il tellurio (o tellurio di potassio) è stato usato per la prima volta in medicina da 1890 per il trattamento della sudorazione notturna nei pazienti con tubercolosi.
Inoltre, piccole quantità di tellurio vengono utilizzate per la vulcanizzazione della gomma, nei detonatori e per la tintura di vetro e ceramica. I sali di tellurio sono in parte utilizzati per produrre un colore verde erba nei fuochi d'artificio.
Istruzioni di sicurezza e tossicità
In forma solubile, il tellurio è un elemento velenoso per l'organismo umano ed è stato quindi classificato come velenoso in passato. Tuttavia, poiché il tellurio elementare è molto poco solubile in acqua e negli acidi del corpo, è stato declassato a dannoso. Studi condotti dall'Organizzazione olandese per la ricerca scientifica applicata (TNO) hanno dimostrato che il valore della DL50 (orale) per i ratti è> 5000 mg / kg. Il valore di 83 mg / kg fornito in molte schede di dati di sicurezza dal libro Toxicometric Parameters of Industrial Toxic Chemicals under single Exposure di NF Ismerow, che risale al 1982, [26] si applica solo ai composti di tellurio facilmente solubili. Nonostante ciò, vari produttori continuano a utilizzare il vecchio valore LD50 per il tellurio elementare (polvere) e la classificazione tossica in connessione con la frase H 301 ("Tossico se ingerito").
Il tellurio non è tossico come il selenio. Questo è analogo agli elementi vicini di 5. Gruppo principale, in cui l'antimonio è anche meno tossico dell'arsenico. Se il tellurio, specialmente sotto forma di composti di tellurio facilmente solubili come i tellurati di metalli alcalini (ad es. Na2TeO3) per ingestione (orale) nel corpo, si forma mediante riduzione dimetiltelluride tossica (Me2Te: H3C-Te-CH3), che provoca danni al sangue, Può causare cuore e reni. Poiché i composti di tellurio facilmente solubili rilasciano molto più tellurio, sono anche classificati come più pericolosi. L'avvelenamento da tellurio si manifesta in un intenso odore di aglio dell'aria respirabile, causato dalla dimetiltelluride, dapprima da Christian Gottlob Gmelin, 1824 (per i suoi primi studi sull'effetto del tellurio sugli esseri viventi). Questo richiederà diverse settimane per svilupparsi e svilupparsi anche a livelli molto bassi, che non causano avvelenamenti gravi. Questo odore di aglio, a differenza dell'aglio reale, non può essere rimosso lavandosi i denti. Si stabilisce anche in una stanza e si allontana solo dopo diverse ore. Inoltre viene lentamente escreto attraverso la pelle.
Le polveri di Tellurst possono infiammarsi spontaneamente nell'aria e, se distribuite finemente in una corrispondente concentrazione, possono anche reagire in modo esplosivo, formando in ogni caso biossido di tellurio TeO2. Come altre polveri metalliche, anche la polvere di tellurio può reagire in modo esplosivo con composti alogenati come il pentafluoruro di bromo BrF5. Non è stata stabilita una concentrazione massima sul luogo di lavoro (MAK) per il tellurio.
prova
Il tellurio elementare può essere rilevato nell'acido solforico concentrato caldo (H2SO4) mediante ossidazione del tellurio per formare il catione rosso Te42 + (dicitura tetratellurica). Parte dell'acido solforico è ridotta nella reazione all'acido solforico (H2SO3), che si decompone a causa delle alte temperature nell'acqua (H2O) e del suo anidride solforosa (DI2), che fuoriesce come gas:
Il colore del catione quadrato planare Te42 + è dovuto a sei elettroni π delocalizzati che assorbono parte della luce visibile. Le restanti lunghezze d'onda della luce non assorbite danno il colore complementare rosso.
Tellurate e tellurite possono essere specificate mediante polarografia, cioè selettivamente determinate fianco a fianco. Mentre il livello di tellurato è -1,66 V, quello della tellurite appare a -1,22 V (rispetto a SCE, 0,1 M soda caustica). Entrambe le specie di tellurio sono ridotte in un solo passaggio al tellururo. Tracce di 0,03% tellurato o 0,003% tellurite sono rilevabili in questo modo. Significativamente più forti sono i metodi della spettroscopia atomica. Mentre la fiamma AAS raggiunge un limite di rilevazione di 20 μg / l, questo valore è molto più basso per il tubo di grafite AAS (0,2 μg / l) e la tecnica dell'idruro (0,02 μg / l).
tellurio
Nei composti, il tellurio si presenta più frequentemente negli stati di ossidazione -II (tellururi) e + IV (tetraalidi, biossido di tellurio e tellurati (IV), telluriti obsoleti). Più rari sono gli stati di ossidazione + VI (tellurati (VI)) e + II (dihalides) nonché -I (ditellurides) e + I (monohalides, noto solo come TeI).
composti di idrogeno
Telluric Hydrogen H2Te è un gas incolore e altamente tossico prodotto dalla reazione dei telluridi (MxTey) con acidi forti, come l'acido cloridrico HCl. Dagli elementi (idrogeno e tellurio), il composto può essere rappresentato come un composto fortemente endotermico solo a temperature superiori a 650 ° C. Dissolto in acqua (acido tellurico), reagisce acido, l'acidità corrisponde approssimativamente all'acido fosforico. Nell'aria, la soluzione acquosa si decompone immediatamente in acqua e tellurio elementare.
composti ossigenati
Biossido di tellurio (tellurio (IV) ossido) TeO2 è un solido cristallino incolore e l'ossido più importante del tellurio. Deriva dalla combustione del tellurio elementare con l'aria. È l'anidride dell'acido tellurico debolmente anfotero e instabile H2TeO3. Il biossido di tellurio esiste in una modifica ortorombica (tellurite) e tetragonale (paratellurit), che si verificano anche in natura come minerali.
Triossido di tellurio (tellurio (VI) ossido) TeO3 è un solido cristallizzante giallo, trigonale / romboedrico e l'anidride dell'acido ortotellurico H6TeO6. Deriva dal drenaggio dell'acido ortotellurico da un forte aumento della temperatura. Il colore giallo è dovuto al trasferimento di elettroni dell'ossigeno nel tellurio ("trasferimento di carica").
Monossido di tellurio (tellurio (II) ossido) TeO è un altro, ma in condizioni standard ossido instabile di tellurio. È descritto come un solido amorfo nero e reagisce in aria umida con ossigeno per formare il biossido di tellurio più stabile TeO2.
Il pentossido dicellulare (tellurio (IV) tellurio (VI) ossido) è un ossido di tellurio misto con cationi Te4 + e Te6 +. Si aggiunge al triossido di tellurio un altro prodotto nella decomposizione termica dell'acido ortotellurico e cristallizzato nel sistema di cristalli monoclino.
I tellurati sono i sali dell'acido ortotellurico H6TeO6 e dell'acido metatellurico H2TeO4 con gli anioni [TeO6] 6- o [TeO4] 2-. I sali dell'acido tellurico H2TeO3 con l'anione [TeO3] 2- sono chiamati tellurati (IV) (telluriti obsolete).
composti alogenati
I tetraalidi TeX4 con tellurio allo stato di ossidazione + IV sono gli alogenuri di tellurio più comuni. Questi sono noti con tutti gli alogeni (fluoro, cloro, bromo e iodio). Tutti i composti sono solidi cristallini.
Dihalides TeX2 con tellurio nello stato di ossidazione + II sono noti solo con cloro, bromo e iodio, esistono solo nella fase gassosa.
I monoalidi TeX esistono di tellurio solo con iodio come ioduro di tellurio TeI. È l'unico noto ioduro termodinamicamente stabile di calcogeni e un solido cristallino scuro. Il tellurio in questo composto ha lo stato di ossidazione insolito + I.
I subaluri contengono Te con uno stato di ossidazione inferiore a + I. I rappresentanti stabili sono Te2I, Te2Br e Te3Cl2.
Gli esalalidi TeX6 con tellurio nello stato di ossidazione + VI sono noti solo come esafluoruro di tellurio TeF6 o cloruro di pentafluoruro di tellurio TeF5Cl. Entrambi sono gas incolori. L'esafluoruro di tellurio è l'esafluoruro di calcogeno più reattivo (oltre all'esafluoruro di zolfo SF6 e all'esafluoruro di selenio SeF6) ed è l'unico ad essere idrolizzato in acqua.
Inoltre, il tellurio allo stato di ossidazione + IV in soluzione acquosa presenta anche composti complessi [TeX6] 2- (X = F-, Cl-, Br-, I-) con tutti gli ioni alogenuri. Ad eccezione del complesso esafluoro, tutti gli altri sono perfettamente ottaedrici nella struttura e possono anche essere precipitati come sali dalla soluzione (ad esempio, esacloridotellurato di ammonio giallo (IV) (NH4) 2 [TeCl6], ammonio esabromidotellurato marrone rossastro (IV) (NH4) 2 [TeBr6] o esioiodidotellurato di cesio nero (IV) Cs2 [TeI6]).
connessioni organo-tellurio
Il tellurio forma una serie di composti organometallici. Tuttavia, questi sono molto instabili e sono poco usati nella sintesi organica. Come composti organici di tellurio e organo della forma R2Te, R2Te2, R4Te e R6Te (R sono ciascuno alchile, arile) sono noti.
Inoltre, sono noti anche diorganotellur dihalides R2TeX2 (R = alchyl, aryl, X = F, Cl, Br, I) e triorganotellurhalides R3TeX (R = alkyl, aryl, X = F, Cl, Br, I).
Tellurpolykationen
Polycation Te72+ in Te7[essere2Cl6]
Tramite un'attenta ossidazione del tellurio, oltre al già citato Te42 +, è possibile preparare e cristallizzare numerose polycations del tellurio Tenx + con un apposito controione. Il controion deve essere una base di Lewis debole poiché le polycations del tellurio sono acidi di Lewis relativamente forti. Agenti ossidanti adatti sono spesso alogenuri dei metalli di transizione, che a temperature tipicamente 200 ° C forniscono direttamente il composto desiderato:
Spesso, la cristallizzazione ha successo nelle condizioni di trasporto chimico, ma a volte si devono usare solventi anidri come il cloruro stannico o il tetrabromuro di silicio. In alcuni casi, i sali fusi sono anche mezzi di reazione adatti Se l'alogenuro di metallo non è un agente ossidante adatto, come è generalmente il caso degli alogenuri degli elementi del gruppo principale, i corrispondenti tetraalidi di tellurio possono essere usati come agenti ossidanti:
Variando il controionone e il mezzo di reazione, potrebbe essere rappresentata un'ampia varietà di polycations; Polycations misti di selenio-tellurio sono accessibili anche mediante un'opportuna scelta dei reagenti della sintesi. Oltre alla catena mostrata o polycations a forma di banda, ci sono anche polycations isolate come Te62 +, Te64 + e Te84 +.
Prezzo del tellurio
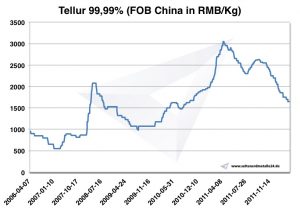
Grafico Tellurium 2006-2011
Prezzi del tellurio -> prezzi per metalli strategici










![{\ mathrm {8 \ Te \ + \ 2 \ UBr_ {5} \ longrightarrow \ Te_ {8} [U_ {2} Br _ {{10}}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/766123b2cbd2af42e846172c00731419fb95bc1b)
![{\ mathrm {13 \ Te \ + \ TeCl_ {4} \ + \ 4 \ BeCl_ {2} \ longrightarrow \ 2 \ Te_ {7} [Be_ {2} Cl_ {6}]}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/c1d391160b6e1fdb357b4a11ea7abd720a1cb0ba)
