Sodio, Na, numero atomico 11
Prezzo, presenza, estrazione e utilizzo del sodio
Il sodio è un elemento chimico frequente con il simbolo Na e il numero atomico 11. Nella tavola periodica degli elementi è nel 3° periodo e come metallo alcalino nel 1° gruppo IUPAC o 1° gruppo principale. Il sodio è un elemento puro, il cui unico isotopo stabile è il 23Na.
 Il sodio elementare fu ottenuto per la prima volta dall'idrossido di sodio da Humphry Davy nel 1807 mediante elettrolisi a sale fuso e chiamato sodio. Questa designazione è utilizzata nelle aree linguistiche inglese e francese, derivati da essa nel romanzo e in parte anche nelle lingue slave. Il nome tedesco sodio deriva dall'arabo نطرون, DMG naṭrūn, Natron, dall'egiziano netjerj. Il sodio e i suoi derivati sono usati in Scandinavia, olandese e in alcune lingue slave, tranne che in lingua tedesca. In giapponese, il sodio ha il nome dal suono tedesco Japanese ナ ト リ ウ ム Natoriumu.
Il sodio elementare fu ottenuto per la prima volta dall'idrossido di sodio da Humphry Davy nel 1807 mediante elettrolisi a sale fuso e chiamato sodio. Questa designazione è utilizzata nelle aree linguistiche inglese e francese, derivati da essa nel romanzo e in parte anche nelle lingue slave. Il nome tedesco sodio deriva dall'arabo نطرون, DMG naṭrūn, Natron, dall'egiziano netjerj. Il sodio e i suoi derivati sono usati in Scandinavia, olandese e in alcune lingue slave, tranne che in lingua tedesca. In giapponese, il sodio ha il nome dal suono tedesco Japanese ナ ト リ ウ ム Natoriumu.
In condizioni normali, il sodio è un metallo ceroso, argenteo e altamente reattivo. A causa della sua forte reattività, il sodio metallico (elementare) viene immagazzinato in condizioni inerti, principalmente in olio di paraffina o petrolio, per quantità maggiori in fusti di acciaio a tenuta d'aria.
Il sodio è uno dei dieci elementi più comuni nel guscio terrestre e si trova in numerosi minerali nella crosta terrestre. L'acqua di mare contiene una quantità significativa di sodio sotto forma di ioni sodio.
Storia
Nell'antichità, gli egiziani coniarono il termine netjerj (neter) per la soda ottenuta dai laghi di soda. I greci adottarono questa parola come greco νίτρον nitron, i romani come nitrium, gli arabi come natrun. A differenza del metallo elementare, i composti del sodio sono noti da molto tempo e da allora sono stati estratti dall'acqua di mare o dai laghi, estratti da giacimenti sotterranei e commercializzati. Il più importante composto di sodio, il sale da cucina (cloruro di sodio), si otteneva nelle miniere o facendo essiccare in saline acqua di mare o acqua di sorgente salata. Il commercio del sale è stato alla base della loro ricchezza per molte città, e in alcuni casi ha anche plasmato i loro nomi (Salzgitter, Salisburgo). Toponimi come Hallstatt, Hallein, Halle (Saale), Bad Hall, Bad Reichenhall, Schwäbisch Hall, Schweizerhalle o Hall in Tirol alludono al nome germanico di Saline (Hall). Anche altri composti di sodio presenti in natura come il carbonato di sodio (soda o bicarbonato di sodio) e il nitrato di sodio sono stati estratti e commercializzati fin dall'antichità.
Fu solo nel 1807 che Humphry Davy riuscì a produrre sodio elementare attraverso l'elettrolisi dell'idrossido di sodio fuso (soda caustica) utilizzando colonne voltaiche come fonte di energia. Come riferì alla Royal Society di Londra il 19 novembre 1807, vinse due metalli diversi: chiamò il sodio contenuto nella soda sodio, che è il nome ancora usato nei paesi di lingua francese e inglese; l'altro metallo lo chiamò potassio. Nel 1811 Berzelius suggerì l'attuale nome sodio.
Presenza
 Nell'universo, il sodio è il 14° in frequenza, paragonabile al calcio e al nichel. La linea gialla D del sodio può essere facilmente rilevata nella luce emessa da molti corpi celesti, compresa quella del sole.
Nell'universo, il sodio è il 14° in frequenza, paragonabile al calcio e al nichel. La linea gialla D del sodio può essere facilmente rilevata nella luce emessa da molti corpi celesti, compresa quella del sole.
Il sodio è il sesto elemento più abbondante sulla terra, costituendo il 2,36% della crosta terrestre. Per la sua reattività, non si presenta in forma elementare, ma sempre in composti, i sali di sodio. L'acqua di mare è una grande riserva di sodio. Un litro di acqua di mare contiene in media 11 grammi di ioni sodio.
I minerali di sodio comuni sono albite (chiamato soda feldspato), NaAlSi3O8 e oligoclasi (Na, Ca) Al (Si, Al) 3O8. Oltre a questi minerali che formano la roccia, che fanno parte dei feldspati, il sodio si trova in grandi depositi di sale. Vi sono soprattutto grandi giacimenti di salgemma (cloruro di sodio, colloquialmente spesso chiamato salgemma), che sono sorti dal prosciugamento di parti del mare. Questi rappresentano la fonte più importante per l'estrazione del sodio e dei suoi composti.I siti di produzione di sale tedeschi ben noti includono Salzgitter, Bad Reichenhall, Stade e Bad Friedrichshall.
Oltre al comune cloruro di sodio, in natura si trovano altri composti. Nitrato di sodio o nitrato di sodio (chiamato anche nitrato del Cile) NaNO3 è uno dei pochi minerali nitrati naturali. Per la sua buona solubilità in acqua, si trova solo in zone particolarmente aride, come il deserto di Atacama in Cile. Prima dell'invenzione del processo Haber-Bosch, questa era la materia prima più importante per molti fertilizzanti ed esplosivi.
Il carbonato di sodio Na2CO3 si trova anche naturalmente in diversi minerali. Il minerale più noto è la soda Na2CO3 · 10 H2O. Viene estratto in grandi quantità e utilizzato principalmente nella produzione del vetro.
Ci sono anche un gran numero di altri minerali di sodio (vedi anche: Categoria: Minerali di sodio). Una nota è la criolite (pietra di ghiaccio, Na3 [AlF6]), che allo stato fuso funge da solvente per l'ossido di alluminio nella produzione di alluminio. Poiché l'unico deposito di criolite noto è estratto in Groenlandia, la criolite viene prodotta artificialmente.
Estrazione e presentazione

La produzione su larga scala di sodio viene effettuata mediante elettrolisi a sale fuso di cloruro di sodio secco in una cosiddetta cella di Down (brevettata nel 1924 da James C. Downs). Per abbassare il punto di fusione viene utilizzata una miscela di sale eutettico di cloruro di calcio 60% e cloruro di sodio 40%, che fonde a 580 ° C. Il cloruro di bario è anche possibile come additivo. Viene applicata una tensione di circa sette volt. Per produrre un chilogrammo di sodio vengono utilizzati circa 10 kWh di elettricità durante l'elettrolisi e circa 12 kWh nell'intero processo produttivo.
Formazione di sodio sul catodo
Formazione di cloro sull'anodo
Risposta generale
La cella di elettrolisi cilindrica è costituita da un anodo centrale in grafite e da un anello catodico laterale in ferro. Sopra la cella c'è una campana che raccoglie e scarica il cloro che si è formato. Il sodio si raccoglie sopra i catodi e viene rimosso dalla cella attraverso un tubo montante raffreddato. Anche il calcio che si è formato si cristallizza lì e ricade nel fuso.
L'elettrolisi del cloruro di sodio ha sostituito il processo Castner. Il sodio è stato ottenuto mediante elettrolisi a sale fuso di idrossido di sodio. Questo aveva il vantaggio del punto di fusione più basso dell'idrossido di sodio (318 ° C), ma è necessaria più energia elettrica. Dall'introduzione dell'elettrolisi del sale fuso cloro-alcali, il prezzo del sodio è diminuito drasticamente. In termini di volume, il sodio è quindi il metallo leggero più economico di tutti. Il prezzo, però, dipende molto dai costi dell'energia elettrica e dal prezzo anche del cloro che viene prodotto.
Proprietà fisiche
 Il sodio è un metallo bianco argenteo, morbido e leggero. In molte proprietà si colloca tra il litio e il potassio. Il punto di fusione di 97,82°C è compreso tra quello del litio (180,54°C) e quello del potassio (63,6°C). Questo è simile con il punto di ebollizione e la capacità termica specifica. Con una densità di 0,968 g · cm − 3, il sodio è uno degli elementi specificamente più leggeri. Degli elementi solidi a temperatura ambiente, solo il litio e il potassio hanno una densità inferiore. Con una durezza Mohs di 0,5, il sodio è così morbido che può essere tagliato con un coltello.
Il sodio è un metallo bianco argenteo, morbido e leggero. In molte proprietà si colloca tra il litio e il potassio. Il punto di fusione di 97,82°C è compreso tra quello del litio (180,54°C) e quello del potassio (63,6°C). Questo è simile con il punto di ebollizione e la capacità termica specifica. Con una densità di 0,968 g · cm − 3, il sodio è uno degli elementi specificamente più leggeri. Degli elementi solidi a temperatura ambiente, solo il litio e il potassio hanno una densità inferiore. Con una durezza Mohs di 0,5, il sodio è così morbido che può essere tagliato con un coltello.
Come gli altri metalli alcalini, il sodio cristallizza nel sistema cristallino cubico in un reticolo a corpo centrato con il gruppo spaziale Im3m (gruppo spaziale n. 229) e due unità di formula per cella unitaria. Al di sotto di 51 K si trasforma in un imballaggio esagonale più vicino di sfere con i parametri reticolari a = 376 pm e c = 615 pm.
Il vapore di sodio è costituito sia da singoli atomi di metallo che da dimeri della forma Na2. Al punto di ebollizione, il 16% degli atomi è sotto forma di dimeri. Il vapore è giallo e appare viola se visto attraverso.
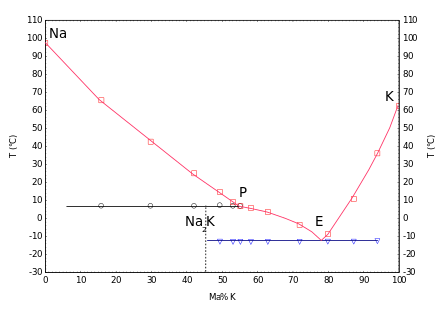
Con il potassio si formano miscele liquide in un'ampia gamma di concentrazioni a temperatura ambiente. Il diagramma di fase mostra un composto di fusione incongruente Na7K a 2 ° C e un eutettico a -12,6 ° C con un contenuto di potassio del 77% (frazione di massa).
Proprietà chimiche
 Come gli altri metalli alcalini, il sodio è un elemento molto basico (potenziale normale: -2,71 V) e reagisce facilmente con molti altri elementi e talvolta con composti. Le reazioni sono particolarmente violente con i non metalli, come il cloro o lo zolfo, e avvengono con una fiamma gialla brillante.
Come gli altri metalli alcalini, il sodio è un elemento molto basico (potenziale normale: -2,71 V) e reagisce facilmente con molti altri elementi e talvolta con composti. Le reazioni sono particolarmente violente con i non metalli, come il cloro o lo zolfo, e avvengono con una fiamma gialla brillante.
L'ossigeno altrimenti reattivo è una specialità.Il sodio e l'ossigeno non reagiscono direttamente tra loro senza la presenza di acqua a temperatura ambiente o quando vengono riscaldati. In un'atmosfera di ossigeno completamente anidra, il sodio può anche essere fuso senza reagire. Se invece sono presenti tracce di umidità, si brucia facilmente formando perossido di sodio.
Reazione del sodio con l'ossigeno
La reazione fortemente esotermica del sodio con l'acqua
 Il sodio reagisce con l'acqua per formare idrossido di sodio, formando idrogeno. Le registrazioni ad alta velocità della reazione dei metalli alcalini con l'acqua suggeriscono un'esplosione di Coulomb.
Il sodio reagisce con l'acqua per formare idrossido di sodio, formando idrogeno. Le registrazioni ad alta velocità della reazione dei metalli alcalini con l'acqua suggeriscono un'esplosione di Coulomb.
Reazione del sodio con l'acqua
Negli alcoli, il sodio viene convertito in alcolati di sodio con formazione di idrogeno. Spesso si scioglie a causa dell'elevato calore di reazione. Se il sodio è distribuito finemente e la risultante superficie di reazione è ampia, la reazione può essere esplosiva e innescare l'idrogeno.
Reazione del sodio con etanolo
Se il sodio entra in contatto con composti clorurati quali diclorometano, cloroformio, tetracloruro di carbonio si ha una reazione rapida ed esotermica con formazione di cloruro di sodio.
Sodio disciolto in ammoniaca liquida
Il sodio si dissolve in ammoniaca liquida di colore blu. Il colore si basa sugli elettroni liberi che vengono rilasciati nella soluzione dal sodio. La soluzione conduce anche corrente elettrica ed è paramagnetica diluita. L'anione del sodio, lo ione sodio, ad esempio sotto forma di potassio (2.2.2-cryptand) natride (K + (C222) Na-) può essere rappresentato in modo simile. È un agente riducente molto potente.
isotopo
Del sodio sono noti un totale di 19 isotopi e altri 3 isomeri del nucleo da 18Na a 37Na. Di questi, solo uno si trova in natura, l'isotopo 23Na. Questo rende il sodio uno dei 22 elementi puri. Gli isotopi artificiali più longevi sono 22Na, che si converte in 2,602Ne con un'emivita di 22 anni sotto decadimento beta più (β +) e 24Na, che decade anche a 14,957Mg con un'emivita di 24 ore sotto decadimento beta. Questi sono usati come traccianti nella medicina nucleare. Il 22Na può essere prodotto irradiando bersagli di magnesio o alluminio con protoni da un ciclotrone per diverse settimane.
Tutti gli altri isotopi e isomeri hanno solo brevi emivite di secondi o millisecondi.
Utilizzare

Il sodio è il metallo alcalino più utilizzato. Viene utilizzato per vari scopi sia tecnicamente che in laboratorio. Nelle lezioni scolastiche e durante le lezioni sperimentali, il sodio può essere utilizzato per produrre idrogeno con l'ausilio di un cucchiaio di sodio e dell'acqua. Un certo numero di composti di sodio sono fatti da parte del sodio. Questi sono, ad esempio, il perossido di sodio usato come agente sbiancante e l'ammide di sodio a base forte. Questi non si trovano in natura e non possono essere ottenuti direttamente dal cloruro di sodio. Il cianuro di sodio e l'idruro di sodio sono fatti di sodio. Poiché il sodio influenza la struttura di solidificazione, può essere utilizzato come aggiunta alle leghe di alluminio-silicio (processo di raffinazione secondo Aladár Pácz).
Catalizzatore
Il sodio catalizza la polimerizzazione dell'1,3-butadiene e dell'isoprene. Quindi è stato utilizzato per la produzione di gomma artificiale. La plastica prodotta utilizzando il sodio come catalizzatore, nota come buna, è stata la prima gomma artificiale al mondo. Dal 1937 fu prodotto negli stabilimenti Buna (dal nome del butadiene e del sodio) a Schkopau.
Liquido di raffreddamento
Poiché il sodio con una conduttività termica di 140 W/(m · K), che è ben al di sopra di quella dell'acciaio (da 15 a 58 W/(m · K)), ha buone proprietà di trasferimento del calore e ha anche un basso punto di fusione con un ampia gamma di liquidi allo stesso tempo viene utilizzato come liquido di raffreddamento per raffreddare le valvole di scarico nei motori a combustione interna, che sono soggetti a carichi termici elevati. A tale scopo, gli steli delle valvole sono realizzati cavi e parzialmente riempiti di sodio. Durante il funzionamento, il sodio si scioglie e scorre avanti e indietro tra i lati caldo e freddo. Il calore viene trasportato lontano dal disco della valvola incandescente.
Gli allevatori veloci vengono raffreddati con sodio fuso. In tali reattori autofertilizzanti, i neutroni veloci prodotti durante la fissione nucleare non devono essere rallentati tra le barre di combustibile, come in altri tipi di reattore. Pertanto, l'acqua, che funge da agente frenante (moderatore), non deve essere utilizzata per il raffreddamento. Il calore viene poi ceduto al generatore di vapore per il funzionamento della turbina tramite un circuito secondario al sodio.
Generazione di luce
Le lampade a vapori di sodio utilizzano la caratteristica luce gialla che i vapori di sodio emettono durante una scarica elettrica. Per la loro elevata efficienza luminosa, vengono spesso utilizzati per l'illuminazione stradale.
Agente riducente
Alcuni metalli, come il titanio, lo zirconio, il tantalio o l'uranio, non possono essere ottenuti per riduzione con carbonio perché si formano carburi stabili e non separabili. Oltre ad alcuni altri elementi, in particolare alluminio e magnesio, viene quindi utilizzato come agente riducente il sodio. Un altro elemento che il sodio è usato per produrre è il potassio. Poiché il potassio è un elemento molto basico, non può essere ottenuto per riduzione con il carbonio. Una produzione teoricamente possibile per elettrolisi non è tecnicamente possibile a causa della buona solubilità del potassio in una fusione di cloruro di potassio.
Il sodio svolge un ruolo importante come agente riducente nella sintesi organica. Per lungo tempo, l'applicazione tecnica più importante del sodio è stata la produzione di piombo tetraetile dal cloroetano. Questo era un importante agente antidetonante che veniva aggiunto alla benzina. Per motivi ambientali, l'uso del piombo tetraetile è stato severamente limitato o vietato del tutto. Pertanto, il consumo di sodio è diminuito. Altrimenti, il sodio viene utilizzato in altre reazioni come la riduzione della betulla e l'accoppiamento del pinacol. Tuttavia, questi sono più interessanti su scala di laboratorio.
essiccante
Poiché il sodio reagisce anche con tracce di acqua, il filo di sodio appena pressato può essere utilizzato per essiccare solventi organici come dietil etere o toluene. Questo metodo non è adatto per solventi contenenti alogeni (esempi: cloruro di metilene, cloroformio) a causa della violenta reazione con l'atomo di cloro.
Le leghe sodio-potassio sono liquide a temperatura ambiente. Questi sono usati per il trasferimento di calore e la dealogenazione nella sintesi organica. Na-K si presta bene all'essiccazione di alcuni solventi ben preessiccati al fine di ottenere contenuti di acqua residua particolarmente bassi.
Conduttore elettrico
Durante gli anni '1960 furono sperimentati cavi al sodio con guaina in polietilene. A causa della minore conduttività, un ipotetico cavo al sodio avrebbe un diametro maggiore del 75%.
prova
 La rivelazione qualitativa e la determinazione quantitativa vengono effettuate mediante spettroscopia atomica attraverso il colore giallo intenso della fiamma o, più precisamente, attraverso la doppia riga del Na a 588,99 nm e 589,59 nm.
La rivelazione qualitativa e la determinazione quantitativa vengono effettuate mediante spettroscopia atomica attraverso il colore giallo intenso della fiamma o, più precisamente, attraverso la doppia riga del Na a 588,99 nm e 589,59 nm.
La rilevazione del sodio in modo puramente chimico è molto difficile. Poiché quasi tutti i composti del sodio sono facilmente solubili in acqua, le classiche reazioni di precipitazione e le determinazioni gravimetriche sono difficilmente possibili. Fanno eccezione l'acetato di sodio magnesio uranile NaMg (UO2) 3 (CH3COO) 9 · 9 H2O giallo e l'esaidroxoantimonato di sodio incolore Na [Sb (OH) 6], entrambi scarsamente solubili. È possibile una reazione di precipitazione con il sale doppio solfato-bismuto 3Na2SO4 · 2Bi2 (SO4) 3 · 2H2O. Poiché gli ioni sodio sono incolori in soluzione acquosa, le reazioni cromatiche vengono raramente eseguite. Pertanto, a parte la cromatografia ionica, solo i metodi spettroscopici sono di importanza pratica.
Fisiologia
Il sodio è uno degli elementi essenziali per tutti gli organismi animali. Nell'organismo animale, il sodio - insieme al cloro - è il nono elemento più comune ed è il terzo ione inorganico più comune dopo calcio e potassio. Fisiologicamente è quindi uno degli elementi di massa. Il sodio si trova negli esseri viventi sotto forma di ioni Na+.
Con un peso corporeo medio di 70 kg, il corpo umano contiene circa 100 g di sodio come ioni Na+. Due terzi di questo è disponibile come NaCl e un terzo come NaHCO3. Poiché costituisce il 90% degli elettroliti extracellulari nel corpo umano, la concentrazione di sodio determina il volume del liquido interstiziale attraverso il volume del vaso.
Assunzioni di sodio consigliate ed effettive
Secondo i valori di riferimento DA-CH, il valore stimato per l'assunzione minima di sodio è di 550 mg/die per gli adulti. Tuttavia, varie organizzazioni hanno formulato raccomandazioni in particolare per un apporto massimo di sodio (OMS: 2 g/giorno; AHA: 1,5 g/giorno).
L'apporto giornaliero effettivo di sodio è spesso al di sopra di questi valori. La ragione di ciò è il nostro consumo di sale relativamente elevato (2,5 g di sale contengono circa 1 g di sodio). Il National Consumption Study II (NVS II) del Max Rubner Institute, in cui il consumo di sodio è stato determinato mediante questionari, ha mostrato un'assunzione mediana di 3,2 g/die (uomini) e 2,4 g/die (donne). L'assunzione effettiva di sodio è presumibilmente anche maggiore, poiché la registrazione tramite questionari è soggetta a errori. La determinazione del sodio nelle urine delle 24 ore funge da gold standard per determinare l'assunzione di sodio. Secondo un rapporto dell'OMS, l'escrezione di sodio nello studio INTERSALT in vari luoghi della Germania era di 4,1–4,5 g/giorno (uomini) e 2,7–3,5 g/giorno (donne).
Regolazione del bilancio del sodio
Il contenuto di sodio è strettamente controllato ed è strettamente correlato alla regolazione del bilancio idrico. La normale concentrazione di sodio nel siero è di circa 135–145 mmol/l. Se il livello di sodio è inferiore, si parla di iponatriemia, in cui si verifica un aumento del volume cellulare. Nell'ipernatriemia, invece, il livello di sodio è troppo alto e le cellule si restringono. In entrambi i casi, la principale compromissione è il funzionamento del cervello. Può portare a crisi epilettiche e disturbi della coscienza fino al coma. Il sistema renina-angiotensina-aldosterone, adiuretina e atriopeptina svolgono un ruolo importante nella regolazione.
L'organo chiave nella regolazione del sodio è il rene. Questo è responsabile per trattenere l'acqua in caso di eccesso di sodio per diluire il sodio nel corpo ed espellere il sodio stesso. Se c'è una carenza di sodio, viene escreta più acqua e il sodio viene trattenuto. Va notato, tuttavia, che i reni hanno bisogno di un po' di tempo prima di poter reagire al cambiamento del livello di sodio.
Distribuzione nelle cellule
Gli ioni Na+ non sono distribuiti uniformemente nell'organismo, anzi, come per gli altri ioni, le concentrazioni all'interno e all'esterno delle cellule sono molto diverse. Questi gradienti di concentrazione di Na + - e Cl- (principalmente all'esterno), K + - e anioni organici (principalmente all'interno) determinano la maggior parte del potenziale di membrana delle cellule viventi. Questo potenziale di membrana e i gradienti ionici sono vitali per la maggior parte delle cellule. Poiché i piccoli ioni inorganici migrano costantemente nell'area vicina a causa delle differenze di concentrazione, è necessario un processo attivo per contrastarlo. Il ruolo più importante è svolto dalla pompa sodio-potassio, che pompa ripetutamente ioni Na + e K + mentre consuma energia.
Funzioni nelle cellule nervose
Gli ioni Na+ svolgono un ruolo importante nella generazione e trasmissione di eccitazioni nelle cellule nervose (e nelle fibre muscolari). Alle postsinapsi delle cellule nervose (e sulla placca neuromuscolare delle fibre muscolari) sono presenti alcuni recettori che, dopo essere stati attivati dai neurotrasmettitori rilasciati dalla cellula nervosa precedente quando è eccitata, si aprono e diventano permeabili agli ioni sodio. L'afflusso di sodio provoca un cambiamento locale nel potenziale di membrana della cellula, che è stabile allo stato fondamentale. L'interno diventa meno negativo rispetto all'esterno, questo si chiama depolarizzazione. Se questa depolarizzazione è ancora abbastanza forte sulla strada per l'assone, si apre un altro tipo di canale del sodio. Questi sono i canali del sodio voltaggio-dipendenti dell'assone, che trasmettono la depolarizzazione locale - insieme ad altri canali ionici - attraverso uno specifico ritmo di apertura e chiusura. Sugli assoni delle cellule nervose si crea un'onda di tensione continua, il potenziale d'azione. La pompa sodio-potassio svolge un ruolo essenziale nel ripristino dello stato di base.
Sodio nelle piante
Nelle piante, invece, il sodio svolge un ruolo subordinato. Mentre il potassio è essenziale per tutte le piante e la maggior parte dei microrganismi, il sodio è richiesto solo da alcune piante C4 e CAM, ma di solito non dalle piante C3. A seconda della posizione, tuttavia, le piante che possono beneficiare dell'assunzione di sodio si sono sviluppate indipendentemente da ciò. Queste piante, dette alofite, sono particolarmente comuni nelle regioni costiere o in altre zone dove il terreno ha un'alta concentrazione di sodio. Le alofite come la barbabietola da zucchero, il cavolo e molte graminacee C4 sono tolleranti al sale, in quanto possono trasportare il sodio fuori dal cilindro centrale nei vacuoli delle cellule fogliari, dove, come ione osmoticamente efficace, aumenta il turgore e quindi aumenta l'allungamento cellulare e al posto del potassio influenza positivamente la crescita dell'area fogliare. Il sodio quindi sostituisce parzialmente il potassio, ma in un'altra parte ha anche un ulteriore effetto di promozione della crescita.
Le piante che non possono trasportare il sodio dal cilindro centrale nelle cellule fogliari lo accumulano nel parenchima xilematico. Queste cosiddette piante natrofobiche includono fagioli e mais, tra gli altri. Il sodio, se entrasse nelle cellule fogliari, non potrebbe essere trasportato nei vacuoli, ma rimarrebbe nel plasma cellulare (citosol) e lì si sposterebbe il potassio che è importante per la formazione dei polimeri (carenza di potassio indotta dal sodio) . Questo alla fine ha portato a un'inibizione della fotosintesi. L'accumulo di sodio nel cilindro centrale della radice e nel tessuto del fusto ha un effetto negativo sulla pianta quando la concentrazione di sodio è elevata. L'aumento del valore osmotico gli impedisce di assorbire e trasportare acqua. Le foglie non sono sufficientemente fornite di acqua e sostanze nutritive, il che porta a una riduzione della fotosintesi.
Poiché la maggior parte delle piante contiene solo piccole quantità di sodio, molti erbivori devono ingerire ulteriore cloruro di sodio dai depositi di sale naturali.
sicurezza
Piccole quantità di sodio sono immagazzinate sotto il petrolio. Per quantità maggiori sono disponibili sistemi di manipolazione integrati con atmosfera di gas protettivo. Nonostante il gas protettivo o il petrolio, il sodio è spesso ricoperto da uno strato di idrossido di sodio e ossido di sodio.
Gli incendi di sodio possono essere estinti con polvere di fuoco metallica (sale da cucina), cloruro di potassio, trucioli di ghisa grigia o come improvvisato con sabbia o cemento secco. Tuttavia, sabbia e cemento reagiscono in una certa misura con il sodio, il che riduce l'effetto estinguente. In nessun caso possono essere utilizzati acqua, schiuma, polvere secca, anidride carbonica o halon. Alcuni di questi agenti estinguenti reagiscono fortemente in modo esotermico con il sodio, il che può portare a incendi ed esplosioni più gravi.
Connessioni
Nei composti, il sodio si trova esclusivamente nello stato di ossidazione +1. Tutti i composti hanno un carattere fortemente ionico e quasi tutti sono facilmente solubili in acqua. I composti di sodio sono tra i sali più importanti di molti acidi. I sali di sodio sono per lo più utilizzati industrialmente per ottenere i corrispondenti anioni, in quanto la loro sintesi è poco costosa.
composti alogenati
Il cloruro di sodio (NaCl), spesso indicato come sale da cucina o sale da cucina, è il sale di sodio più importante e più conosciuto. Poiché si presenta in grandi quantità, è la materia prima più importante per l'estrazione del sodio e di altri composti del sodio. Il cloruro di sodio è la fonte più importante di sodio per l'uomo, tecnicamente viene utilizzato, tra l'altro, per conservare gli alimenti e come sale stradale nel traffico stradale. Prende il nome dalla struttura del cloruro di sodio, struttura cristallina tipica di molti sali.
Inoltre, tutti gli altri possibili alogenuri di sodio, cioè fluoruro di sodio NaF, bromuro di sodio NaBr e ioduro di sodio NaI, sono noti e stabili.
composti ossigenati
Sono noti un totale di cinque ossidi di sodio. Questi sono ossido di sodio Na2O, perossido di sodio Na2O2, iperossido di sodio NaO2, triossido di disodio Na2O3 e triossido di sodio NaO3. L'ossido di sodio è contenuto in molti bicchieri; è creato dal carbonato di sodio utilizzato nella produzione del vetro. Quando il sodio viene bruciato, viene prodotto solo a determinate temperature (150-200 ° C) e quantità di sodio e ossigeno utilizzate stechiometricamente. In caso contrario, il sodio brucia in perossido di sodio. Questo è un forte agente ossidante e tecnicamente l'ossido di sodio più importante. È usato come candeggina per tessuti e carta, nonché come fonte di ossigeno nelle immersioni e nei sottomarini. Gli altri ossidi sono molto instabili e si decompongono rapidamente.
L'idrossido di sodio (NaOH) è una delle basi più importanti nell'industria. La soluzione acquosa di idrossido di sodio è chiamata soda caustica. Viene utilizzato, tra l'altro, per la produzione di sapone e coloranti, nonché per la digestione della bauxite nella produzione di alluminio.
composti dello zolfo
Il sodio forma due sali con idrogeno solforato, sodio solfuro Na2S e sodio idrogeno solforato NaHS. Entrambi sono utilizzati, tra l'altro, per la precipitazione dei metalli pesanti.
Il solfato di sodio Na2SO4, il sale sodico dell'acido solforico, è utilizzato nei detersivi e nell'industria cartaria nel processo al solfato. Come altri anioni bivalenti, anche il solfato forma idrogeno solfato di sodio oltre al solfato di sodio. Anche altri acidi ossi-zolfo formano sali di sodio. Un esempio è il tiosolfato di sodio Na2S2O3, che viene utilizzato come sale fissante nella fotografia analogica.
idruri
In sodio idruro NaH e sodio boroidruro NaBH4, l'idrogeno è nello stato di ossidazione -1. Entrambi sono utilizzati principalmente nella chimica organica. L'idruro di sodio viene essenzialmente utilizzato come base forte e poco nucleofila per la deprotonazione di tioli, alcoli, ammidi, composti CH-acidi, ecc., mentre il boroidruro di sodio viene utilizzato per ridurre z. B. di chetoni. Quest'ultima reazione può essere condotta selettivamente per i chetoni dalla presenza di composti di cerio (III) (riduzione di Luche). Se entrano in contatto con l'acqua, viene prodotto idrogeno H2 gassoso.
Più composti di sodio
Il carbonato di sodio Na2CO3 e l'idrogenocarbonato di sodio NaHCO3 sono i sali di sodio dell'acido carbonico. Insieme al cloruro di sodio e all'idrossido di sodio, sono tra i più importanti composti di sodio. Il carbonato di sodio (spesso indicato con il nome comune soda) è utilizzato in grandi quantità nella produzione del vetro. Il bicarbonato di sodio viene utilizzato come bicarbonato di sodio. Quando riscaldato, forma anidride carbonica e acqua con acidi.
Nitrato di sodio NaNO3, il sale sodico dell'acido nitrico, è uno dei rari composti di nitrati presenti in natura (nitrato del Cile). Il nitrato di sodio è usato come fertilizzante e come conservante.
I composti organici del sodio, contrariamente a quelli del litio, sono molto instabili. Sono estremamente reattivi e talvolta possono reagire con idrocarburi alifatici altrimenti non reattivi. Solo i composti con radicali aromatici, come il ciclopentadiene, che possono essere utilizzati come agenti riducenti, sono sufficientemente stabili per applicazioni nelle reazioni.
I saponi sono sali di sodio o di potassio degli acidi grassi. Per la produzione, i grassi vengono bolliti con una soluzione di soda caustica o idrossido di potassio. Questo processo è chiamato bollitura del sapone, la saponificazione della reazione chimica. I grassi vengono scomposti in glicerina e sali alcalini degli acidi grassi (i veri e propri saponi). In alternativa, i saponi possono essere prodotti direttamente da acidi grassi liberi facendoli reagire con alcali per formare i loro sali. Acidi grassi adatti sono ad esempio acido laurico, acido miristico, acido palmitico, acido stearico, acido oleico e acido ricinoleico.






