Antimonio, Sb, numero atomico 51
Prezzo, storia, occorrenza, estrazione e uso dell'antimonio
antimonio
L'antimonio (dal latino Antimonium, probabilmente dall'arabo "al-ithmîd (un)" è un elemento chimico con l'elemento simbolo Sb (dal latino Stibium, (grigio) luccio lucido) e il numero atomico 51 Nella tavola periodica è nella 5. Periodo e il gruppo principale 5, o 15, gruppo IUPAC o gruppo azoto. Nella modifica stabile, è un semimetallo lucente e argenteo.
Nome, storia
Si ritiene inoltre che il nome risalga al tardo anthemon greco (fioritura tedesca). Lo scopo era quello di descrivere i cristalli simili a gambi di solfuro di antimonio, che apparivano come ciuffi di fiori e sembravano un fiore. In 11. Century si trova il termine latino per la medicina minerale farmaco antimonium per la terapia interna delle malattie poi con Costantino Africano.
In 17. Nel diciannovesimo secolo, il nome antimonio veniva usato per riferirsi al metallo. Il termine copto per il trucco in polvere antimonio solfuro è andato oltre il greco nello stibio latino. L'abbreviazione Sb utilizzata dal medico e chimico svedese Jöns Jakob Berzelius ("padre della chimica moderna") è ancora oggi utilizzata come simbolo di elemento.
Un'etimologia popolare tardivamente leggendaria immortalata da Samuel Johnson nel suo dizionario afferma che il monaco tedesco Basilius Valentinus osservò che i maiali si ingrassarono rapidamente assorbendo l'antimonio. Provò anche questo sui suoi frati, ma alla fine morirono, così che fu coniato il termine "antimoine" (antimonio), da cui in seguito fu creata "antimonio".
Una località tipica per l'antimonio solido è la miniera d'argento nel comune svedese di Sala in Västmanland. Tuttavia, l'antimonio metallico era già noto ai cinesi e ai babilonesi. Alcuni dei suoi composti erano già usati nell'età del bronzo come supplemento al rame per produrre bronzo (reperti di Velem St. Vid in Ungheria).
Presenza
L'antimonio è un elemento raro. Poiché può anche essere trovato in natura (cioè in forma elementare), è certificato dall'International Mineralogical Association (IMA) con il sistema n. 1.CA.05 riconosciuto come minerale.
L'antimonio solido (2011) è stato rilevato in tutto il mondo nei siti 300. Quindi, tra l'altro, in diverse regioni dell'Australia; nei dipartimenti boliviani di La Paz e Potosí; Minas Gerais in Brasile; Foresta Nera, Fichtelgebirge, Foresta dell'Alto Palatinato, Odenwald e Harz in Germania; Seinäjoki in Finlandia; diverse regioni della Francia; Lombardia, Piemonte, Sardegna e Trentino Alto Adige in Italia; alcune regioni del Canada; alcune regioni dell'Austria; Siberia orientale e occidentale e Urali in Russia; oltre a Västmanland, Dalarna, Gästrikland, Närke, Södermanland, Värmland e Västerbotten in Svezia; in alcune regioni della Slovacchia; Boemia e Moravia nella Repubblica Ceca e in molte regioni degli Stati Uniti. Uno dei depositi più importanti al mondo di antimonio solido e minerali di antimonio è la cintura greenstone Murchison nella gamma Murchison del Sud Africa.
Finora sono noti i minerali di antimonio 264 (a partire da: 2010). Utilizzato principalmente è il minerale solfuro Stibnit Sb2S3 (Grauspießglanz) con un contenuto massimo di 71,7% Sb. Il minerale con il più alto contenuto di Sb in un composto chimico è la lega di arsenico naturale antimonio Paradocrasit (max 92%). Tuttavia, viene fornito con solo tre località, a differenza di Stibnit (intorno ai siti 2500), molto meno comuni. Altre fonti di antimonio sono i minerali Valentinit Sb2O3 (Weißspießglanz), Breithauptit NiSb (nichel antimonio, antimonide nichel), Kermesit Sb2S2O (brillio rosso) e Sb2S5 (zolfo d'oro).
Estrazione e presentazione
Tecnicamente, l'antimonio viene estratto dal gloss dell'antimonio. Un metodo si basa sulla tostatura e riduzione con carbonio (metodo di riduzione riduttiva):
Un'altra possibilità è effettuare la riduzione con ferro (metodo delle precipitazioni):
In tutto il mondo erano all'inizio di 21. Secolo tra 110.000 e 160.000 tonnellate di antimonio all'anno promosse. Da 1900, l'output è aumentato di oltre dieci volte.
87% della produzione di antimonio avviene in Cina (a partire da: 2015).
Proprietà
L'antimonio può verificarsi in tre diverse modifiche, con l'antimonio metallico o grigio la modifica più coerente.
In condizioni normali, l'antimonio cristallizza il trigonale nella configurazione romboedrica nel gruppo spaziale R3m (n. 166) descritto secondo il simbolismo di Hermann Mauguin con i parametri reticolari a = 431 pm ec c = 1127 pm e sei unità di formula per unità di cella.
Estinguendo il vapore di antimonio su superfici fredde, si forma antimonio amorfo, nero e altamente reattivo, che viene riconvertito in antimonio metallico mediante riscaldamento. La produzione elettrolitica produce antimonio esplosivo che, quando incrinato, diventa esplosivo e si accende in antimonio metallico. Tuttavia, questo modulo contiene sempre del cloro e non può essere considerato una modifica. Anche l'antimonio giallo non è una modifica indipendente, ma un composto chimico altamente polimerico con idrogeno.
Proprietà fisiche
L'antimonio metallico è bianco-argento, molto lucido, traballante grossolanamente cristallino. È facile da schiacciare per la sua fragilità. La conduttività elettrica e termica è bassa.
Proprietà chimiche
Con idrogeno nascente, l'antimonio reagisce con l'idruro di antimonio instabile SbH3. L'aria e l'acqua non attaccano l'antimonio a temperatura ambiente. Sopra il punto di fusione, brucia in aria con una fiamma bianco-bluastra verso l'ossido di antimonio (III). Si dissolve in acidi minerali concentrati a caldo. Con gli alogeni, reagisce vigorosamente a temperatura ambiente agli alogenuri corrispondenti.
Nei composti, l'antimonio è presente principalmente negli stati di ossidazione + 3 e + 5. In antimonidi metallici come l'antimonide di potassio K3Sb forma ioni Sb3.
isotopo
Esistono due isotopi di antimonio stabili: 121Sb e 123Sb.
Uso e leghe
La maggior parte dell'antimonio prodotto viene trasformato in leghe e mostra le seguenti proprietà:
Serve per indurire piombo e leghe di stagno. Contrariamente alla maggior parte degli altri metalli, si espande con il raffreddamento del fuso (dovuto alla conversione in un'altra modifica): il contenuto di antimonio può essere regolato in modo tale che tali leghe non si restringano al restringimento o si espandano in qualche modo; Quando le parti vengono prodotte in stampi per fusione, il metallo preme durante la solidificazione in tutti gli angoli e angoli, in modo che anche le forme complicate e le superfici fortemente modellate possano essere rese prive di vuoti.
Leghe importanti:
- Leghe piombo-antimonio: piombo duro, metallo per lettere, metallo per cuscinetti, piombo per accumulatore, guaina di piombo per cavi sotterranei
- Leghe stagno-antimonio: metallo Britannia, metallo portante
- Produzione di semiconduttori, ad es. B. mediante drogaggio di silicio, per la produzione di semiconduttori composti di III V.
- Leghe di stagno-antimonio-rame (metallo Babbit) per metalli portanti
- Leghe di stagno-antimonio-rame-piombo per peltro e altri articoli di stagno
cosiddetta saldatura o saldatura dolce - Antimonio di alluminio, antimonio di gallio, antimonio di indio per dispositivi a infrarossi ed effetto Hall
- Leghe di antimonio antiritiro per colate di precisione
Medicina
L'antimonio (o una preparazione derivata dal minerale di antimonio) era nell'16. e 17. Divenne una "medicina di piombo" iatrochimica, ma fu - come altre droghe paracelsiane - controversa e proibita anche in Francia tra 1615 e 1688.
Il tartaro è stato a lungo usato come agente di rifrazione (pillola di antimonio), oggi è ancora talvolta usato per studiare il contenuto dello stomaco degli uccelli.
Sia la schistosomiasi che i tripanosomi stavano iniziando all'inizio di 19. Secolo con Brechweinstein (Kaliumantimonyltartrat) combattuto. La pietra tartara è stata prodotta conservando il vino in una tazza di antimonio per un giorno e poi bevendolo. Nel frattempo, vengono utilizzati farmaci più efficaci e più compatibili.
Gli integratori di antimonio sono comunemente usati come forme pentavalenti meno tossiche per la terapia farmacologica della leishmaniosi e della schistosomiasi, ma non sono più il farmaco di prima scelta nei paesi sviluppati. L'antimonio inibisce l'enzima fosfofructochinasi, che è la fase di limitazione della velocità nella glicolisi.
Altro
- Partita di Kindling
- Parte di detonatori di esplosivi e munizioni al piombo.
- Trisolfuro di antimonio nelle pastiglie dei freni dei veicoli
Antimonio (V) solfuro di: - per la produzione (vulcanizzazione) di gomma rossa (esempio: tubi di gomma da laboratorio)
- come componente rosso della testa di fuoco nelle partite
- prima del trucco degli occhi e in oftalmologia ("Augenerweiterer")
- Cromato di antimonio come pigmento di colore giallo
ossidi di antimonio - Catalizzatore per la produzione di poliestere e PET (ossido di antimonio (III))
- come pigmento bianco per colorare polistirolo, polietilene e polipropilene
- Produzione di smalti bianchi e fritte (porcellana)
- Purificazione di vetro al piombo
- drogato con stagno come rivestimento conduttivo trasparente (ossidi di stagno antimonio "ATO"), ad esempio su vetri, per la produzione di schermi o in pigmenti elettricamente conduttivi ("Minatec"), per rivestimenti di pavimenti per la dissipazione di cariche elettrostatiche.
- nei pigmenti ("Lazerflair") per la marcatura laser di parti in plastica, a causa del forte assorbimento del normale laser per marcatura a radiazione infrarossa (Nd: YAG).
- in mimetica a causa del forte assorbimento a infrarossi.
- come ritardante di fiamma e come componente di vernici resistenti alla fiamma e ritardanti di fiamma,
- Materie plastiche e tessuti per rivestimento di cavi, coprisedili per auto, tessuti per tende, abbigliamento per bambini e altro ancora. Ä.
- Sali di antimonio come componente di pesticidi, macchie e fuochi d'artificio
- Divisore per l'oro: per la precipitazione dell'argento dalla fusione dell'oro
tossicità
L'antimonio può essere fatale per ingestione da 200 a 1200 mg. In tossicologia sono note tre forme di antimonio, di cui l'idruro di antimonio gassoso (Stiban, SbH3) è la forma più pericolosa che induce un'emolisi massiva. A seguito di tossicità, l'emetico tartaro segue con antimonio trivalente ("trivalente"), mentre l'antimonio pentavalente è il meno tossico.
L'antimonio trivalente viene assorbito nei globuli rossi entro le prime due ore dall'ingestione allo 95% e quindi arricchito principalmente in organi fortemente perfusi. L'escrezione è principalmente dovuta al legame con il glutatione attraverso la bile con una circolazione enteroepatica corrispondentemente elevata e solo una piccola parte viene eliminata attraverso i reni. L'antimonil tartrato di potassio viene escreto in 90% entro il primo giorno dopo l'ingestione, il resto è 10% a causa di una cinetica di eliminazione più lenta nei giorni 16.
Si ritiene che l'antimonio, come l'arsenico, inibisca la funzione del complesso piruvato deidrogenasi, portando a una carenza del trasportatore di energia intracellulare adenosina trifosfato (ATP). Ciò porta alla formazione di complessi chelati tra i gruppi antimonio e tiolo degli enzimi corrispondenti. Nel corpo, è tossico in molti organi, tra cui il tratto digestivo, il fegato, i reni, il cuore e il sistema nervoso centrale. La concentrazione più alta raggiunge l'antimonio nel fegato, dove può arrivare a un'epatite fino all'insufficienza epatica. Al cuore ci sono cambiamenti dell'ECG con inversione e riduzione dell'onda T e intervallo QT prolungato. L'insufficienza renale acuta può portare a emodialisi temporanea o permanente.
Oltre a misure di supporto come la terapia infusionale (sia per compensare la perdita di liquidi attraverso il vomito sia per proteggere i reni) e un attento monitoraggio dei segni vitali e dell'ECG, il carbone attivo, la N-acetilcisteina come precursore del glutatione, viene utilizzato per l'avvelenamento antimicrobico aumento della secrezione e un agente chelante, ad es. B. Dimercaprol.
I risultati della ricerca indicano che i composti di antimonio irritano la pelle e le mucose. Questi composti probabilmente si dissolvono da plastica e tessuti.
Istruzioni di sicurezza e valori limite
Dei composti di antimonio, l'UE ha classificato il fluoruro di antimonio come tossico (T) e i cloruri come corrosivo (C) e pericoloso per l'ambiente (N); tutti gli altri composti di antimonio dannosi (Xn) e pericolosi per l'ambiente (N). L'antimonio stesso non è elencato lì, secondo la scheda di sicurezza, è etichettato come irritante.
L'Agenzia internazionale per la ricerca sul cancro (IARC) classifica l'ossido di antimonio (III) come una possibile sostanza cancerogena.
Nell'UE, l'acqua potabile ha un limite di 5 μg / l. Gli esami del succo di frutta in bottiglia in bottiglie di PET (per i quali non esistono linee guida) hanno rivelato concentrazioni di antimonio fino a 44,7 μg / L in concentrati di succo non diluito.
L'antimonio è stato aggiunto a 2016 dall'UE ai sensi del regolamento (CE) n. 1907 / 2006 (REACH) nel contesto della valutazione delle sostanze nel piano d'azione comunitario a rotazione (CoRAP). Rivaluterà l'impatto della sostanza sulla salute umana o sull'ambiente e, se del caso, avvierà il follow-up. Le ragioni principali dell'assorbimento dell'antimonio erano le preoccupazioni sull'esposizione dei lavoratori, sul tonnellaggio elevato (aggregato), sull'alto rapporto di rischio (RCR) e sull'uso diffuso, nonché sul potenziale rischio di proprietà cancerogene. La rivalutazione parte da 2018 ed è effettuata dalla Germania.
prova
prove preliminari:
Colorazione della fiamma: Fiamma blu pallido, poco caratteristico Fosforsalzperle: incolore (disturbato da tutti gli elementi che producono una perla colorata)
reazione di rilevazione:
Riduzione dei metalli di base, ad esempio ferro, zinco o stagno.
Nelle soluzioni non acide, i metalli di base riducono i cationi di antimonio Sb (III), Sb (V) e Sb (III) / (V) all'antimonio metallico:
2 Sb3 + + 3 Fe → 2 Sb + 3 Fe2 +
La sostanza da testare per l'antimonio viene posta in soluzione di acido cloridrico e miscelata con polvere di ferro. Il risultato è un precipitato nero e traballante di antimonio metallico nella soluzione o direttamente sul ferro. È anche possibile la prova di un chiodo di ferro. Qui, un deposito nero sull'unghia è una prova dell'antimonio, che ha depositato qui elementare.
Il campione Marsh consente un chiaro rilevamento dell'antimonio. Quando la sostanza depositata piroliticamente (specchio lucido scuro) non si dissolve in perossido di idrogeno ammoniacale, l'arsenico e il germanio sono esclusi come possibili alternative.
La determinazione altamente sensibile di minuscole tracce di antimonio avviene attraverso la tecnica dell'idruro della spettrometria atomica. In linea di principio, il campione Marsh è accoppiato alla spettrometria di assorbimento atomico. Gli effetti matrice della soluzione campione possono essere soppressi in modo molto efficace.
Un altro metodo è quello di trattare una soluzione acquosa contenente ioni di antimonio con soluzione di rodamina B. Forma un complesso colorato che è estraibile con etere isopropilico. Tuttavia, questa prova è piuttosto aspecifica, poiché oro, cadmio, gallio, tallio, uranio e ioni di tungsteno formano complessi colorati.
Connessioni
- Idrogeno di antimonio, chiamato anche monostiban SbH3.
- Gas tossico che si forma da antimonio e acidi.
- Distiban (Sb2H4)
composti alogenati
- Il fluoruro di antimonio (V) (SbF5) forma (secondo VSEPR) una piramide quadrata e si ibrida con sp3d
- Antimonio (V) cloruro (SbCl5)
- Fluoro di antimonio (III) (SbF3)
- Antimonio (III) cloruro (SbCl3)
- Bromuro di antimonio (III) (SbBr3)
- Ioduro di antimonio (III) (SbI3)
composti ossigenati
- Ossido di antimonio (III) (triossido di antimonio, Sb2O3)
- Ossido di antimonio (III, V) (tetrossido di antimonio, Sb2O4)
- Ossido di antimonio (V) (pentaossido di antimonio, Sb2O5)
- Acido di antimonio / triidrossido di antimonio (H3SbO3 / Sb (OH) 3)
- Acido di antimonio / acido di antimonio (III), SbOOH o HSbO2
- Acido antimonico (HSb (OH) 6)
composti dello zolfo
- Trisolfuro di antimonio, chiamato anche lucido antimonio (Sb2S3)
Steli metallici grigio-neri e lucidi. Materiale di partenza per la produzione di antimonio metallico. Solubile in acidi forti. Utilizzare per fiammiferi, occhiali da sfregamento e vernici mimetiche (riflesso della luce IR). - Pentasolfuro di antimonio, precedentemente noto come zolfo d'oro (Sb2S5)
Altri composti
- Antimonio (V) cloruro di cloruro (SbCl4F) (catalizzatore per la produzione di politetrafluoroetilene ("Teflon"))
- Antimonide di alluminio (AlSb)
- Antimonide di gallio (GaSb)
- Antimonide di indio (InSb)
Grafico dell'antimonio 2005-2020
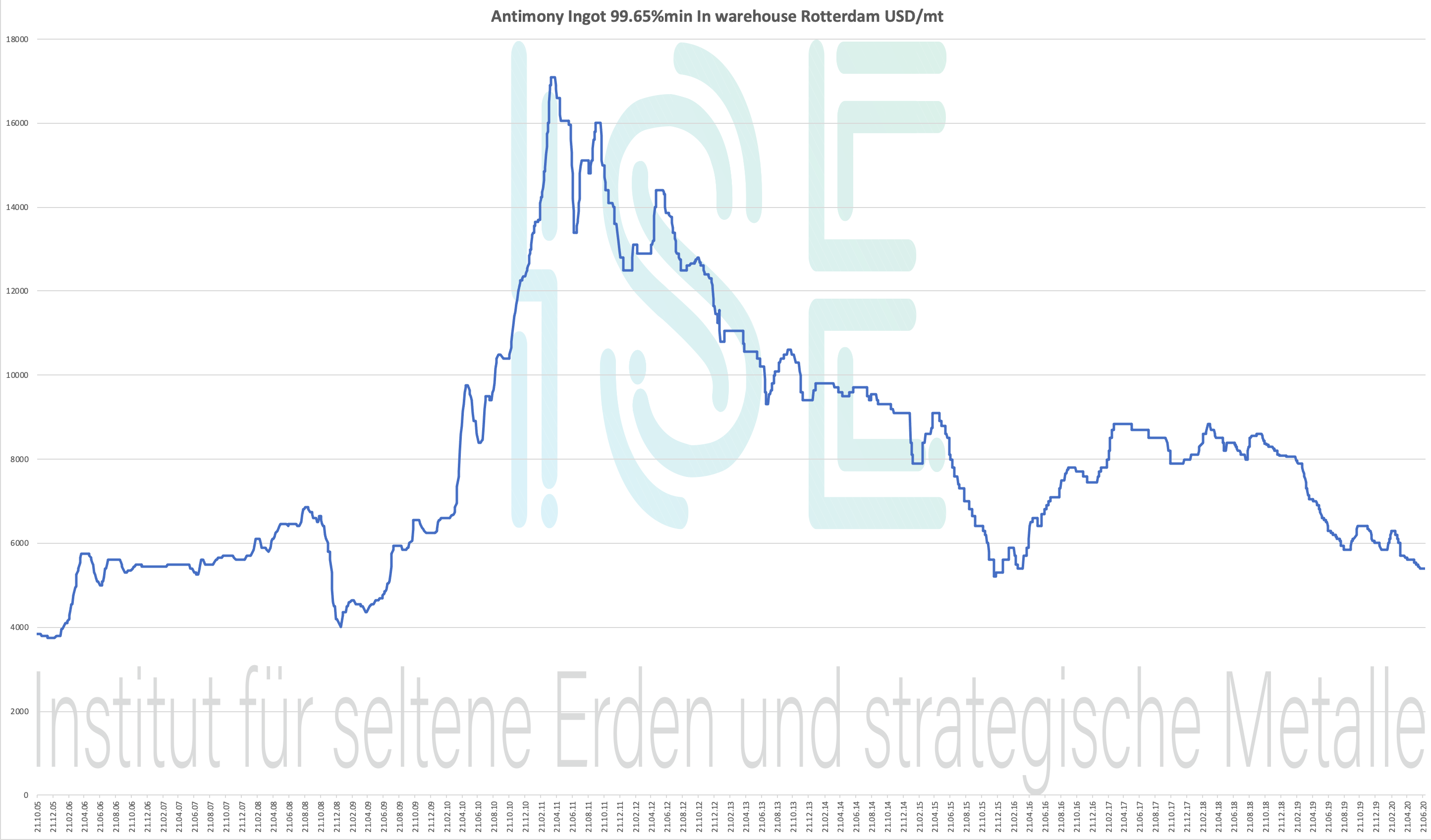
Lingotto di antimonio 99.65% min. In magazzino Rotterdam USD / mt
Tabella prezzi 2004-2020 - clicca per ingrandire
Prezzo dell'antimonio: inferiore al prezzo dei metalli strategici
Dati storici dei prezzi per Lingotto di antimonio 99,65% magazzino Rotterdam USD / mt



