Silicio, Si, numero atomico 14
Prezzo del silicio, presenza, estrazione e uso
Il silicio, anche silicio, è un elemento chimico con il simbolo Si e il numero atomico 14. È nell'4. Gruppo principale (gruppo carbonico) o 14. Gruppo IUPAC e 3. Periodo della tavola periodica degli elementi. In termini di frazione di massa (ppmw), è il secondo elemento più abbondante nel guscio della terra dopo l'ossigeno.
Il silicio è un semi-metallo classico, quindi ha entrambe le proprietà di metalli e non metalli ed è un semiconduttore elementare. Il silicio elementare puro ha un colore grigio-nero e una lucentezza tipicamente metallica, spesso da bronzo a bluastra.
Il silicio è estremamente importante per l'elettronica e poiché 2018 in forma di puro isotopo serve anche per la definizione del chilogrammo. Il silicio elementare non è tossico per il corpo umano, il silicio in forma di silicato legato è importante per l'uomo. Il corpo umano contiene circa 20 mg / kg di massa corporea di silicio; la quantità diminuisce con l'età.
Ortografia ed etimologia
Per impostazione predefinita, viene scritto l'elemento "silicio". La notazione con, c 'è usata principalmente nel gergo chimico. Entrambe le ortografie provengono dal termine latino silicia, silica ', associato al silex latino' pebble ',' rock '.
La parola inglese per silicio è silicio. È incluso, ad esempio, nel nome Silicon Valley. La traduzione occasionalmente riscontrata di silicone è un falso amico, perché i siliconi sono una classe di composti chimici del silicio.
Storia
Utilizzare in tempi preindustriali
I composti di silicio, in particolare le rocce, hanno tradizionalmente svolto un ruolo importante nella storia umana come materiale da costruzione. Un tipico esempio di una struttura in pietra antica è Stonehenge. Un altro importante materiale siliceo che è stato usato per molto tempo come materiale da costruzione è il terriccio, che inizialmente è stato utilizzato nella costruzione di argilla in fibra di ramo, successivamente in forma di mattoni. Il cemento, anch'esso contenente silicato, fu sviluppato per la prima volta dai romani.
A causa dei loro bordi taglienti, le rocce silicee sono state utilizzate anche come strumenti nell'età della pietra. L'ossidiana, ad esempio, era già estratta come materiale per utensili particolarmente adatto nel periodo protostorico e ampiamente distribuita dal commercio. Feuerstein è stato estratto in zone di gesso, come il Belgio e la Danimarca. Nell'estrazione dei metalli, specialmente nella produzione di acciaio, le scorie di silicato sono utilizzate per proteggere le stufe e i forni dall'ingresso di ossigeno e come stampi di argilla o sabbia; forse è stata scoperta la lavorazione del vetro.
La scoperta come elemento
Per la prima volta nell'anno 1789 Antoine Lavoisier ha predetto che Silex è l'ossido di un metallo. Nell'anno 1807, Humphry Davy ha postulato i test elettrochimici per l'esistenza di metalli silicio, alluminio, zirconio e glucinio (berillio).
"Se fossi stato così fortunato da ottenere questo argomento, e per aver procurato le sostanze metalliche che stavo cercando, avrei dovuto proporre i nomi di silicio, allume, zirconio e glucio."
"Se fossi stato così felice di avere prove più affidabili sull'argomento e di aver insegnato le sostanze metalliche che cercavo, avrei suggerito per loro i nomi silicio, allume, zirconio e glucio".
- Humphry Davy
In 1811, il chimico Joseph Louis Gay-Lussac e Louis Jacques Thénard (vedi Thénards Blau) hanno prodotto silicio impuro e amorfo (a-Si, la forma non cristallina, allotropica di silicio). Per fare ciò, hanno reagito al tetrafluoruro di silicio con potassio elementare. Una procedura simile è stata seguita da Xnumx di Jöns Jakob Berzelius in Svezia, facendo reagire un esafluorosilicato con potassio elementare. Berzelius ha pulito il silicio amorfo risultante mediante lavaggio. Fu il primo a riconoscere la natura elementare del silicio e gli diede il nome.
Il termine silicio deriva dalla parola latina silex (ghiaia, pietra focaia). Esprime che il silicio è più comune in molti minerali.
Il termine inglese silicio è stato proposto a 1817 dal chimico scozzese Thomas Thomson (1773-1852). La desinenza -on ha lo scopo di indicare la relazione chimica con il non-metallo carbonio (carbonio) e boro (boro).
La prima produzione di silicio puro e cristallino nell'anno 1854 successe al chimico francese Henri Etienne Sainte-Claire Deville mediante elettrolisi.
Presenza
L'intera terra è circa il X% di massa percentuale di silicio; in particolare, il mantello è composto in larga misura da scioglimento di rocce di silicato. La crosta terrestre è circa 15 percento in peso di silicio; questo lo rende il secondo elemento chimico più abbondante dopo l'ossigeno. Qui, il silicio si presenta essenzialmente sotto forma di minerali di silicato o come silice pura.
Quindi la sabbia è costituita principalmente da silice. Il quarzo è pura silice. Molte gemme sono fatte di biossido di silicio e più o meno miscele di altre sostanze, come ametista, quarzo rosa e fumo, agata, diaspro e opale. Il silicio forma silicati con molti metalli. Esempi di rocce silicee sono mica, amianto, argilla, scisto, feldspato e arenaria. Gli oceani rappresentano anche un enorme serbatoio di silicio: sotto forma di acido silicico monomerico, si dissolve in quantità considerevole in tutti gli oceani. Complessivamente (a partire da: 2011) sono noti i minerali di silicio 1437, con la rara moissanite con un contenuto fino al 70% con il più alto contenuto di silicio (per confronto: il quarzo minerale ha un contenuto di silicio fino al 46,7%).
Poiché il silicio si presenta in natura anche in modo dignitoso, cioè in forma elementare, è riconosciuto dall'International Mineralogical Association (IMA) come minerale ed è nella classificazione Strunz'schen Mineral (edizione 9) con il sistema n. 1.CB.15 (edizione 8: I / B.05-10) ha guidato nel dipartimento dei semimetalli e dei non metalli. Nella maggior parte conosciuta nella classificazione di minerali di lingua inglese secondo Dana, l'elemento minerale porta il sistema n. 01.03.07.01.
Il silicio solido è stato rilevato (2011) nei siti 15, anche per la prima volta nel deposito di Nuevo Potosí a Cuba. Altre località si trovano nella Repubblica popolare cinese, in Russia, in Turchia e negli Stati Uniti.
Silicatkreislauf
I minerali silicatici vengono degradati in modo permanente dalla reazione con l'acido carbonico dell'acqua per formare acido metasilicico e carbonati, come mostrato nell'esempio del silicato di calcio:
L'acido metasilicico insolubile reagisce ulteriormente con acido carbonico per formare acido ortosilicico solubile:
Tuttavia, l'acido ortosilicico reagisce di nuovo con se stesso relativamente rapidamente al biossido di silicio (amorfo) e all'acqua, a condizione che il valore di pH sia ≥ 3. La concentrazione assoluta di acido ortosilicico è relativamente bassa (ad es. <Circa 7 mmol in acqua di mare).
L'incorporazione di silice o silicati solubili in acqua negli organismi marini (1.), Che sedimenti all'estinzione dopo essere annegati, o per vulcanismo e perdite di magma sul fondo del mare regrediscono i minerali di silicato (2.) E il ciclo è chiuso:
L'orizzonte temporale in cui si svolge questo processo è di diversi milioni di anni, quindi è considerevolmente più lungo che nel caso del ciclo del carbonio della natura vivente.
Silicio nella natura vivente
Oltre alla già menzionata natura essenziale del silicio, esistono numerosi organismi che producono strutture contenenti biossido di silicio. I più noti di questi sono le diatomee, le spugne (Porifera, Spongiaria) e i radiolari, che formano un esoscheletro di biossido di silicio mediante condensazione catalizzata da enzimi di acido ortosilicico Si (OH) 4. Molte piante contengono anche silice nei loro steli e foglie. Esempi ben noti qui sono l'equiseto e la pianta di bambù. La spina dorsale di silice integrata conferisce loro ulteriore stabilità.
Significato fisiologico per l'uomo
Il silicio sembra essere necessario per la formazione e la maturazione ossea. Nei vitelli, la somministrazione di ortosilicato ha portato alla proliferazione di collagene nella pelle e nella cartilagine. L'assunzione desiderabile derivata da esperimenti su animali è 30 mg / d. Le carenze nell'uomo non sono ancora note.
La silice o la silice terra sono prodotti orali. In sostanza, contengono anidridi siliciche (biossido di silicio) e si dice che rafforzino la pelle, le unghie, le ossa e il tessuto connettivo e le mantengano in salute. Un effetto non è stato scientificamente provato.
Un eccesso di silicio può causare emolisi eritrocitaria e, di conseguenza diretta, cambiamenti cellulari.
Estrazione in laboratorio
Il silicio elementare può essere ottenuto su scala di laboratorio mediante riduzione, a partire da silice o tetrafluoruro di silicio, con metalli di base. Reazione 2.) È un processo alluminotermico, che funziona solo con l'aggiunta di zolfo elementare, la terza via corrisponde alla scoperta dell'elemento:
Il silicio amorfo altamente reattivo può essere ottenuto mediante riduzione con sodio o acidolisi dei silicidi:
Estrazione nel settore
Il silicio elementare viene utilizzato in diversi gradi di purezza nella metallurgia (ferrosilicio), nel fotovoltaico (celle solari) e nella microelettronica (semiconduttori, chip di computer). Di conseguenza, è comune nel settore classificare il silicio elementare in base a diversi gradi di purezza. Si distingue tra simg (grado metallurgico, silicio grezzo, purezza 98-99%), sisg (grado solare, silicio solare, impurità inferiori a 0,01%) e vittoria (grado elettronico, silicio semiconduttore, piccole impurità 10-9). Per le celle solari, la purezza del materiale lungo tutto il suo spessore è importante per garantire la durata più lunga possibile del supporto, per molte applicazioni in microelettronica solo gli strati superiori da circa 20 a 30 micron devono essere estremamente puri.
Tradizionalmente, viene utilizzato il processo Siemens, in cui il silicio viene prima fatto reagire con acido cloridrico gassoso a 300-350 ° C in un reattore a letto fluidizzato a triclorosilano (silicocloroformio).
Dopo diverse fasi di distillazione, il triclorosilano viene decomposto termicamente in presenza di idrogeno in un'inversione della reazione sopra descritta su barre di silicio iperpure riscaldate a 1000-1200 ° C. Il silicio elementare cresce sulle aste. Il cloruro di idrogeno liberato viene riportato in circolazione. Come sottoprodotto, il tetracloruro di silicio precipita, che viene convertito in triclorosilano e restituito al processo o bruciato nella fiamma dell'ossigeno in silice pirogenica. Il processo Siemens produce 19 kg di rifiuti e sottoprodotti per kg di silicio iperpuro.
silicio grezzo
Su scala industriale, il silicio elementare si ottiene riducendo la silice con il carbonio nel forno di riduzione della fusione a temperature di circa 2000 ° C. Il materiale di partenza è sabbia di quarzo o ghiaia di quarzo.
2002 ha prodotto circa 4,1 milioni di tonnellate di questo silicio grezzo industriale (Simg). È sufficientemente pulito per scopi metallurgici e viene utilizzato come elemento legante e disossidante per acciai (miglioramento della resistenza alla corrosione, soppressione della cementite) e come materia prima per la produzione di silano attraverso il processo Müller-Rochow, che alla fine serve principalmente per la produzione di siliconi. Per la produzione di ferrosilicio per l'industria siderurgica (disossidante nel processo dell'altoforno), la reazione successiva viene opportunamente eseguita in presenza di ferro elementare.
Ulteriori possibilità di digestione di SiO2 sono:
La digestione della soda a circa 1600 ° C nel serbatoio di fusione:
La digestione idrotermale a circa 200 ° C con acqua in autoclave:
silicio solare
Per la produzione di celle solari, il silicio grezzo deve essere ulteriormente purificato in silicio solare (Sisg). Esistono diverse procedure per questo. Questi metodi sono la parte ad alta intensità energetica nella produzione di moduli solari a causa dei numerosi passaggi intermedi complessi. Pertanto, vari metodi di produzione come il metodo UMG (grado metallurgico aggiornato) e il metodo FBR (reattore a letto fluido) vengono ora testati e utilizzati.
Un'alternativa senza cloro è la decomposizione del monosilano, che si decompone nuovamente dopo una fase di pulizia su superfici riscaldate o quando passa attraverso reattori a letto fluidizzato.
Il silicio policristallino (polisilicio) ottenuto in questi modi è adatto per la produzione di moduli solari e ha una purezza superiore al 99,99%. Nella tecnologia solare, come nella microelettronica, vengono sfruttate le proprietà dei semiconduttori del silicio.
Solo di interesse storico è una procedura precedentemente utilizzata dalla società DuPont. Si basava sulla riduzione del tetraclorosilano con vapore di zinco elementare a temperature di 950 ° C.
A causa di problemi tecnici e della grande quantità di rifiuti di cloruro di zinco, tuttavia, questo processo non è più utilizzato oggi.
silicio semiconduttore
Silicio monocristallino semiconduttore
Per applicazioni in microelettronica, è necessario silicio monocristallino di elevata purezza (Sieg). In particolare, le contaminazioni con elementi che sono anche adatte come elementi dopanti devono essere portate a concentrazioni al di sotto di determinati valori critici mediante traino del crogiolo o fusione della zona. Il produttore Shin-Etsu pubblicizza un "11N" -ref (= 99,999 999 999%) dei suoi lingotti.
Nell'estrazione del crogiolo (processo di Czochralski), il silicio solare ottenuto nel processo Siemens viene fuso in crogioli di quarzo. Un cristallo di semi di silicio monocristallino di elevata purezza viene posto in questo fuso e lentamente rimosso dal fuso mentre gira per cristallizzare silicio di elevata purezza in forma monocristallina sul cristallo lasciando quasi tutti i contaminanti nel fuso. Lo sfondo fisico di questo processo di purificazione è la depressione del punto di fusione e la tendenza delle sostanze a cristallizzare il più puro possibile.
In alternativa, durante la fusione della zona con l'aiuto di un riscaldatore a induzione elettrico (a forma di anello), una zona fusa viene fatta passare attraverso un'asta di silicio, per cui gran parte dei contaminanti si dissolve nel fuso e migra con esso.
Il silicio cristallino di elevata purezza è attualmente il materiale di base più adatto per la microelettronica; meno per quanto riguarda le sue proprietà elettriche che a causa delle proprietà chimiche, fisiche e tecniche del silicio e dei suoi composti (biossido di silicio, nitruro di silicio, ecc.). Tutti i chip, la memoria, i transistor ecc. Più comuni utilizzano silicio ad alta purezza come materiale di partenza. Queste applicazioni si basano sul fatto che il silicio è un semiconduttore. Con l'incorporazione mirata di impurità (doping), come indio, antimonio, arsenico, boro o fosforo, le proprietà elettriche del silicio possono essere variate in un ampio intervallo. Soprattutto, mediante gli effetti di giunzione PN così generati si possono realizzare vari circuiti elettronici. A causa della crescente importanza dei circuiti elettronici, si parla anche dell'età del silicio. Il nome della Silicon Valley per la regione high-tech in California indica anche l'enorme importanza del silicio nell'industria dei semiconduttori e dei computer.
Il silicio amorfo può essere convertito in silicio policristallino mediante laser ad eccimeri. Ciò è di crescente importanza per la produzione di transistor a film sottile (TFT) per schermi piatti.
wafer di silicio
Il silicio è disponibile in commercio sia come polvere a grana fine che in pezzi più grandi. Il silicio ad alta purezza per l'uso in moduli solari o in componenti a semiconduttore viene solitamente prodotto sotto forma di sottili dischi di singoli cristalli, i cosiddetti wafer di silicio (vedi Fig.). A causa degli elevati investimenti iniziali e dei lunghi tempi di costruzione dei forni necessari, tuttavia, solo poche aziende in tutto il mondo producono silicio grezzo.
I maggiori produttori di silicio metallurgico sono:
- Elkem (N, USA)
- Invensil (F, USA)
- Globe Metallurgical (USA)
- Rima Metal (Br)
Ci sono circa 15 altri grandi produttori. Esistono numerose opere minori nella Repubblica popolare cinese, che la rendono il più grande produttore del paese.
Il mercato del silicio policristallino e iperpuro è in transizione dalla metà degli 2000. A causa dell'elevata domanda dell'industria solare, 2006 ha avuto una carenza di silicio.
Proprietà fisiche
Il silicio, come germanio, gallio, fosforo e antimonio adiacenti alla tavola periodica, è un semiconduttore elementale. La distanza energetica tra la banda di valenza e la banda di conduzione secondo il modello di banda è 1,107 eV (a temperatura ambiente). Drogando con opportuni elementi dopanti come boro o arsenico, la conducibilità può essere aumentata di un fattore 106. Nel silicio drogato in questo modo, la linea di impurità causata da impurità e difetti reticolari è significativamente più grande di quella della linea intrinseca, motivo per cui tali materiali vengono definiti semiconduttori di impurità. Il parametro grid è 543 pm.
Spettro dell'indice di rifrazione complesso (N = n + ik) di silicio
Il complesso indice di rifrazione, che dipende dalla lunghezza d'onda della luce, è mostrato nell'immagine adiacente. Le informazioni sulla struttura della banda possono essere lette anche qui. Una transizione di banda diretta a 370 nm (EÀ1 = 3,4 eV) può essere osservata sulla base dell'andamento fortemente crescente del coefficiente di estinzione k. Un'altra transizione di banda diretta può essere osservata a ≈ 300 nm (EΓ2 = 4,2 eV). La transizione di banda indiretta del silicio (Es = 1,1 eV) può essere solo ipotizzata. Il fatto che vi siano ulteriori transizioni di banda indirette può essere visto dall'ampia curva di k per lunghezze d'onda> 400 nm.
Come l'acqua e alcune altre sostanze, il silicio presenta un'anomalia della densità: la sua densità in forma liquida (a Tm = 1685 K) è maggiore di 10-11% rispetto a quella solida, cristallina (c-Si) di 300 K.
Proprietà chimiche
In tutti i casi presenti in natura e nella stragrande maggioranza dei composti prodotti sinteticamente, il silicio forma esclusivamente legami singoli. La stabilità del legame singolo Si-O in contrasto con il doppio legame CO è dovuta al suo carattere parziale doppio legame, che risulta dalla sovrapposizione delle coppie solitarie di ossigeno con gli orbitali vuoti di silicio. La regola del doppio legame, che è stata a lungo considerata valida, secondo la quale il silicio è un elemento di 3. Tuttavia, nel frattempo, è diventato obsoleto poiché è ormai noto un gran numero di composti prodotti sinteticamente con doppi legami Si-Si. In 2004, il primo composto con un triplo legame formale Si-Si è stato caratterizzato strutturalmente.
Ad eccezione dell'acido fluoridrico contenente acido nitrico (in cui si forma l'esafluorosilicato), il silicio è insolubile in acidi perché la passivazione avviene attraverso la formazione di uno strato di silice solida. D'altra parte, si dissolve facilmente in alcali caustici caldi con formazione di idrogeno. Nonostante il suo potenziale normale negativo (-0,81 V), è relativamente inerte nella sua forma compatta, poiché si copre con uno strato protettivo di ossido nell'aria.
Proprietà meccaniche
Le proprietà meccaniche del silicio sono anisotropiche (direzionali). A seconda dell'orientamento del cristallo selezionato, il modulo di elasticità assume valori tra 130 GPa e 189 GPa. Una descrizione generale del comportamento elastico è riportata nella notazione Voigt come per tutti i cristalli cubici attraverso le tre costanti elastiche indipendenti C11, C12 e C44. La matrice di elasticità è per il silicio:
Le costanti elastiche hanno i seguenti valori:
I rispettivi moduli elastici possono essere calcolati dalle costanti elastiche per le singole direzioni cristalline principali del silicio (100,110 e 111):
isotopo
Sono noti un totale di isotopi 23 tra 22Si e 45Si di silicio. Di questi, tre, gli isotopi 28Si, 29Si e 30Si, sono stabili e presenti in natura. L'isotopo con la quota maggiore della composizione isotopica naturale è 28Si con 92,223%, 29Si ha una quota di 4,685% e 30Si di 3,092%. Gli isotopi instabili di più lunga durata sono 32Si, che va in 153P (fosforo) con un'emivita di 32 anni in decadimento beta, e 31Si, che decade anche in 157,36P in decadimento beta con un'emivita di 31 minuti. Tutti gli altri isotopi hanno solo emivite brevi di secondi o millisecondi.
28Si si forma in stelle pesanti verso la fine del loro sviluppo in grandi quantità (combustione dell'ossigeno). Questo è il motivo dell'elevata percentuale di 28Si nel silicio totale (92,23%) e anche nella frequenza del silicio rispetto ad altri elementi. Da 2009, sono stati fatti tentativi di ridefinire il chilogrammo dell'unità base SI come un dato insieme di atomi 28Si; questi tentativi hanno portato 2018 a una nuova definizione a novembre. Sono anche stabili gli isotopi 29Si (quota 4,67% del silicio totale) e 30Si (3,1%).
L'isotopo radioattivo 31Si decade rapidamente (emivita 157,3 minuti) dalla radiazione beta a fosforo stabile. Questa circostanza può essere utilizzata per produrre silicio drogato con n omogeneità. A tale scopo, il silicio viene irradiato con neutroni, per cattura dei neutroni si genera quindi 31Si e quindi 31P. Una fonte di neutroni adatta per questo metodo è la fonte di neutroni di ricerca Heinz Maier-Leibnitz. Più durevole è 32Si con un'emivita di 172 anni. Tracce di questo isotopo si formano nell'atmosfera terrestre per spallazione di argon da radiazione cosmica. 32Si decade in 32P ugualmente radioattivo (emivita 14,3 giorni), quindi in 32S stabile (zolfo). Tutti gli altri isotopi si disintegrano in pochi secondi.
Sicurezza
Il silicio è una polvere combustibile come molti elementi. Come polvere e granuli è irritante. Il silicio compatto è innocuo.
Il silicio poroso idrogenato, cioè ricoperto superficialmente da idrogeno, può essere altamente esplosivo sotto l'irradiazione laser e un aumento dell'ossigeno, come hanno scoperto per caso i ricercatori dell'Università tecnica di Monaco. Sono possibili esplosioni nella gamma micrometrica. La velocità di detonazione e l'energia di detonazione sono più elevate rispetto a TNT e dinamite.
Utilizzare in tecnologia
1947 ha scoperto John Bardeen, Walter Brattain e William Shockley la resistenza elettrica controllabile, il transistor, prima su un singolo cristallo al germanio. Il silicio gioioso della connessione potrebbe essere isolato solo più tardi nella purezza necessaria per scopi elettronici. 1958 Robert Noyce di Fairchild e Jack S. Kilby di Texas Instruments hanno sviluppato indipendentemente il circuito integrato (IC) su un chip di silicio. Da circa 1970, il silicio è il materiale di base della maggior parte dei prodotti a semiconduttore ed è il materiale di base per molti sensori e altri sistemi micromeccanici (ad es. Braccio di leva in un microscopio a forza atomica). Il silicio è anche il componente elementare della maggior parte delle celle solari.
A novembre 2005 è stato segnalato sui primi risultati promettenti con i laser al silicio.
Il silicio è usato come combustibile ad alta energia in molti esplosivi.
Poiché il silicio si espande con la solidificazione, mentre la maggior parte delle sostanze si contrae, viene aggiunto a molte leghe fuse. Ad esempio, la ghisa contiene sempre circa 2% Si. Di particolare importanza sono le leghe di alluminio-silicio in cui il contenuto di Si può arrivare fino a 20%. Questa è la varietà più importante di tutti i materiali in alluminio pressofuso.
Connessioni
Il silicio è quasi sempre tetravalente nei composti chimici. Di conseguenza, l'atomo di silicio nei composti è generalmente a quattro coordinate. Inoltre, ora ci sono un certo numero di composti in cui il silicio ha una coordinazione di cinque o sei volte. Oltre al silicio tetravalente e ai composti preparati sinteticamente di silicio bivalente (sililine) sono noti, ma la maggior parte sono molto instabili. Di maggiore importanza è solo il monossido di silicio, che viene utilizzato come materiale per la compensazione delle lenti ottiche. Inoltre, 2012 ha anche rilevato sperimentalmente un composto a tre coordinate simile alla struttura monodimensionale del grafene, il cosiddetto silicene.
L'intera chimica del silicio è essenzialmente caratterizzata dall'alta affinità del silicio per l'ossigeno. Il silicio è di solito il partner elettropositivo di un composto chimico, sebbene esistano anche composti con silicio negato formalmente. Questi sono principalmente silicidi in cui il silicio può anche formare veri anioni.
![]()
Inversione della polarità vincolante
Particolarmente degno di nota è l'inversione della polarità dei legami elemento-idrogeno nella transizione dal carbonio al silicio. Qui, la differenza di elettronegatività cambia da + 0,45 (carbonio-idrogeno) a -0,2, motivo per cui i composti silanici hanno una reattività completamente diversa rispetto agli idrocarburi.
I composti più importanti del silicio possono essere suddivisi nelle seguenti classi, di cui sono citati alcuni rappresentanti:
Connessioni binarie
- carburo di silicio
- silice
- nitruro di silicio
- siliciuri
silicato
- Zircone e tutti gli altri silicati e composti di acido silicico
alogenuri di silicio
- Silicon tetrafluoruro
- Il tetracloruro di silicio
- Triclorosilano (silicocloroformio)
idruri di silicio
- monosilano
- silano
Composti di silicio organico
- Tetrametilsilano (TMS, standard NMR)
- Metilclorosilani come il diclorometilsilano (elementi costitutivi dei siliconi)
- phenylchlorosilane
- carbosilanes
- Carbosilazane
- carbosiloxanes
Composti polimerici al silicio
- I siliconi (siliconi, polorganosilossani) sono formati per polimerizzazione e appartengono alle più importanti materie plastiche industriali.
- I composti polimerici di silicio-ossigeno trovano applicazione in molte aree; Servono come lubrificanti e sigillanti nei settori cosmetico e delle costruzioni.
- Polisilani, -carbosilani, -carbosilazani, -carbosilossani
Altro
Ad oggi, spesso accade che la parola inglese "silicio" (per silicio) sia falsamente tradotta o pronunciata in articoli scientifici famosi o nel doppiaggio cinematografico come "silicone" ("silicone"). Ciò è accaduto, ad esempio, nella serie di fantascienza Star Trek, il thriller dell'agente di James Bond In faccia alla morte o nella serie animata The Simpsons. Esempio: "La forma di vita è in carbonio o silicone?"
Prezzi del silicio
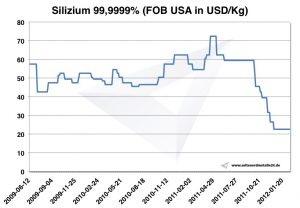
Grafico silicio 2009-2012





















